Мы привыкли к утверждению: «всё живое состоит из клеток». Но существует и неклеточная форма жизни. Это особые организмы – вирусы. Наука, изучающая неклеточные формы жизни называется вирусология. Она связана с другими науками, а самостоятельность приобрела чуть больше ста лет назад. Основоположником этой науки считается Д. И. Ивановский. В своих исследованиях он установил, что источником болезней являются микроскопические организмы – вирусы. Они принадлежат к отдельной группе микроорганизмов. Вирусы являются возбудителями многих болезней представителей животного и растительного мира. Благодаря изучению природы вирусов, появилась возможность диагностировать и лечить болезни, вызываемые ими, а так же предупреждать развитие заболеваний.
Оглавление
- 1 СТРОЕНИЕ ВИРУСОВ.
- 2 ФОРМЫ ВИРУСОВ.
- 3 ОСОБЕННОСТИ СУЩЕСТВОВАНИЯ ВИРУСОВ.
- 4 РЕТРОВИРУСЫ.
- 5 История открытия ретровирусов
- 6 Классификация ретровирусов
- 7 Структура ретровирусов и строение генома
- 8 Жизненный цикл ретровирусов.
- 9 Простые и сложные ретровирусы
- 10 БАКТЕРИОФАГИ.
- 11 Строение бактериофагов
- 12 Классификация бактериофагов
- 13 Жизненный цикл
- 14 Роль бактериофагов в биосфере
- 15 Применение
СТРОЕНИЕ ВИРУСОВ.
Вирусы не имеют клеточного строения. Самые просто устроенные вирусные частицы — вирионы — представляют собой молекулы наследственного материала, заключённые в белковую оболочку. Просто организованные вирусы состоят из нуклеиновой кислоты и нескольких белков, образующих вокруг неё оболочку — капсид. Пример таких вирусов — вирус табачной мозаики. Его капсид содержит один вид белка с небольшой молекулярной массой. Наследственный материал — это молекулы нуклеиновых кислот, в структуре которых содержится информация о строении вирусной частицы. Оболочку вируса, построенную из белковых молекул, называют капсидом (от лат. capsa [ка́пса] — «футляр»). Так выглядит вирус табачной мозаики.

Некоторые вирусы устроены сложнее: поверх капсида у них есть дополнительная оболочка — суперкапсид (от лат. super [су́пер] — «над, выше»). Но и такие вирусы не имеют клеточного строения. К таким относится вирус герпеса человека. Сложно организованные вирусы имеют дополнительную оболочку — белковую или липопротеиновую; иногда в наружных оболочках сложных вирусов содержатся углеводы. Примером сложно организованных вирусов служат возбудители гриппа и герпеса. Их наружная оболочка — это фрагмент ядерной или цитоплазматической мембраны клетки-хозяина, из которой вирус выходит во внеклеточную среду.

Вирусы за редким исключением содержат только один тип нуклеиновой кислоты: либо ДНК (вирус герпеса), либо РНК (вирус табачной мозаики). Некоторые, например мимивирусы, имеют оба типа молекул — и ДНК, и РНК.
Вирусные частицы очень малы. Размеры вирусных частиц настолько малы, что их можно увидеть только с помощью электронного микроскопа. Вирусы мельче бактериальных клеток в 10–100 раз.

.
ФОРМЫ ВИРУСОВ.
Вирусы очень разнообразны по форме. Вирусные частицы имеют разнообразную форму: округлую, вытянутую, палочковидную или даже форму кристалла. Некоторые вирусы имеют белковые хвостовые нити, поверхность других покрыта шипами или выростами сложной формы.

ОСОБЕННОСТИ СУЩЕСТВОВАНИЯ ВИРУСОВ.
Все вирусы — паразиты живых организмов, так как не способны размножаться вне их клеток. Вне клетки организма-хозяина вирусные частицы не проявляют свойств живого и ведут себя как химические вещества.
Попав в клетку, генетический материал вируса начинает воспроизводиться и многократно умножается. Используя генетическую информацию вируса, клетка за счёт собственных ресурсов производит вирусные белки. Таким образом, заражённая клетка превращается в фабрику по производству компонентов вирусных частиц. Из образовавшихся молекул внутри клетки собираются новые вирионы. Затем они разрушают оболочку клетки и после выхода наружу способны заражать соседние клетки.

Процесс вирусного инфицирования в масштабах одной клетки можно условно разбить на несколько взаимно перекрывающихся этапов:
- проникновение в клетку;
- перепрограммирование клетки;
- переход в неактивное состояние (персистенция);
- создание новых вирусных компонентов;
- созревание новых вирусных частиц и их выход из клетки.
Проникновение в клетку.
Вирусу необходимо доставить внутрь клетки свою генетическую информацию. Некоторые вирусы переносят в клетку также собственные белки, необходимые для реализации своей генетической информации. Различные вирусы для проникновения в клетку используют разные стратегии: например, пикорнавирусы впрыскивают свою РНК через плазматическую мембрану, а вирионы ортомиксовирусов захватываются клеткой в ходе эндоцитоза, попадают в кислую среду лизосом, где происходит их окончательное созревание (депротеинизация вирусной частицы), после чего РНК в комплексе с вирусными белками преодолевает лизосомальную мембрану и попадает в цитоплазму. Вирусы также различаются по локализации их репликации: часть вирусов (например, пикорнавирусы) размножается в цитоплазме клетки, а часть (например, ортомиксовирусы) — в её ядре.
Перепрограммирование клетки.
При заражении вирусом в клетке активируются механизмы противовирусной защиты. Заражённые клетки начинают синтезировать сигнальные молекулы — интерфероны, которые активируют системы иммунитета окружающих неза-ражённых клеток. Повреждения, вызываемые размножением вируса в клетке, могут обнаружить системы внутреннего клеточного контроля, и тогда заражённая клетка «покончит жизнь самоубийством» в ходе программируемой клеточ-ной смерти (апоптоза). От способности вируса преодолевать эти системы противовирусной защиты напрямую зависит его выживание. Многие вирусы в ходе эволюции приобрели способность подавлять синтез интерферонов и «выключать» программу апоптоза.
Кроме подавления противовирусной защиты, вирусы стремятся создать благоприятные условия для развития своего потомства в ущерб процессам жизнедеятельности клетки. Пример перепрограммирования работы клетки-хозяина — трансляция РНК энтеровирусов. Вирусная протеаза расщепляет клеточный белок, необходимый для начала (иници-ации) трансляции клеточных иРНК. При этом инициация трансляции РНК самого вируса происходит другим способом — для неё вполне достаточно отрезанного фрагмента белка. Таким образом, вирусные РНК приобретают преимущест-венное право на трансляцию и не конкурируют за рибосомы с РНК клетки.
Переход в неактивное состояние.
Некоторые вирусы могут переходить в скрытое (латентное) состояние, практически не вмешиваясь в процессы, происходящие в клетке, и активироваться лишь при определённых условиях. Какое-то время вирус не разрушает заражённую клетку, иногда он просто интегрируется в клеточный геном и даже наследуется дочерними клетками. Но в определённый момент вирус захватывает контроль над клеточными процессами, так что клетка начинает производить материалы, из которых строятся новые вирусные частицы. Клетка превращается в фабрику по производству вирусов. Зрелые частицы, выходя из клетки, разрывают клеточную мембрану и уничтожают клетку. Выяснено, что с переходом некоторых вирусов в неактивное состояние (персистенцией) связан ряд онкологических заболеваний.
Создание вирусных компонентов.
Размножение вирусов состоит из двух или трёх этапов:
- транскрипция вирусного генома, то есть синтез вирусной иРНК;
- трансляция вирусной иРНК, то есть синтез вирусных белков;
- репликация вирусного генома (для ДНК-содержащих вирусов).
В случаях, когда генетическая информация вируса закодирована в виде РНК, геномная РНК одновременно играет роль иРНК, и процесс транскрипции не происходит за ненадобностью.
У многих вирусов существуют системы контроля, обеспечивающие оптимальное расходование биоматериалов клетки-хозяина. Например, когда вирусной иРНК накоплено достаточно, транскрипция вирусного генома подавляется, а трансляция и репликация, напротив, активируются.
Созревание вирионов и их выход из клетки.
В конечном счёте синтезированные вирусные РНК или ДНК одеваются соответствующими белками и выходят из клетки. Обычно это приводит к смерти клетки, но не всегда. В некоторых случаях, например у ортомиксовирусов, дочерние вирусы отпочковываются от плазматической мембраны, не вызывая её разрыва. Таким образом, клетка организма-хозяина может продолжать жить и продуцировать вирус.
РЕТРОВИРУСЫ.
Ретрови́русы (Retroviridae), семейство вирусов. Содержат РНК в качестве генетического материала, но при заражении
клеток образуют двухцепочечную ДНК — копию своего генома. Ретровирусы вызывают серьёзные заболевания человека, такие как синдром приобретённого иммуннодефицита (СПИД) и Т-клеточный лейкоз у взрослых.
История открытия ретровирусов
Одно из первых открытий, связанных с ретровирусами, было сделано американским учёным Фрэнсисом Пейтоном Раусом в 1911 г. Он идентифицировал вирус саркомы Рауса, ретровирус, вызывающий рак у кур. В 1950-х гг. американский вирусолог Шарлотта Френд и польско-американский генетик Людвик Гросс обнаружили ретровирусы, вызывающие лейкоз у мышей.
Прорыв в исследовании ретровирусов произошёл в 1970 г., когда американский генетик Г. Темин и американский биохимик, молекулярный биолог и вирусолог Дэвид Балтимор, работавшие с вирусом саркомы Рауса, независимо друг от друга открыли фермент обратную транскриптазу. Это открытие было удостоено Нобелевской премии по физиологии и медицине в 1975 г.
В 1980-х гг., на заре эпидемии ВИЧ/СПИДа, исследователи определили вирус иммунодефицита человека (ВИЧ) как возбудитель. ВИЧ стал первым обнаруженным ретровирусом человека. В то же время американский учёный Роберт Галло обнаружил вирус Т-клеточного лейкоза человека типа 1 (HTLV-1). HTLV-1 – ещё один ретровирус, связанный с конкретным типом рака – Т-клеточным лейкозом взрослых.
В начале 21 в. исследования ретровирусов нашли применение в генной терапии и генной инженерии, благодаря своей способности интегрировать провирусы в геномы клеток-хозяев.
Классификация ретровирусов
К ретровирусам относятся 2 подсемейства: Orthoretrovirinae и Spumaretrovirinae. Их отличительной особенностью является способность к обратной транскрипции РНК в ДНК. Обратная транскрипция у Spumaretrovirinae происходит до освобождения вирионов из поражённой клетки, а у Orthoretrovirinae – после проникновения вируса в клетку.
Подсемейство Orthoretrovirinae
Orthoretrovirinae включает в себя 6 родов, которые, кроме вирусов иммунодефицита, получили название в соответствии с буквами греческого алфавита.
Альфаретровирусы (Alpharetrovirus) вызывают злокачественные опухоли у птиц; насчитывают 9 видов, например вирус лейкоза птиц (Avian leukosis virus) и вирус саркомы Рауса.
Бетаретровирусы (Betaretrovirus) поражают мышей, овец и некоторых приматов; известно 5 видов, в том числе вирус опухоли молочных желёз мышей (Mouse mammary tumor virus).
Гаммаретровирусы (Gammaretrovirus) являются причиной саркомы, лейкоза и иммунодефицита у кошачьих, рептилий и птиц; самый многочисленный род ретровирусов, включающий 16 видов, например вирус лейкоза мышей (Murine leukemia virus), вирус лейкемии кошек (Feline leukemia virus) и вирус саркомы кошек (Feline sarcoma virus).
Представители дельтаретровирусов (Deltaretrovirus) могут вызывать лейкоз крупного рогатого скота, к ним относятся 4 вида: вирус лейкоза крупного рогатого скота (Bovine leukemia virus) и 3 типа вируса Т-клеточного лейкоза приматов.
Эпсилонретровирусы (Epsilonretrovirus) обитают в воде, известно 3 вида. Поражают рыб, вызывая у них саркому [вирус дермальной саркомы судака (Walleye dermal sarcoma virus)] и эпидермальную гиперплазию [вирус эпидермальной гиперплазии судака 1 и 2 (Walleye epidermal hyperplasia virus;WEHV-1 и WEHV-2)].
Лентивирусы включают 10 видов и поражают коров, лошадей, коз, представителей семейства кошачьих, обезьян и человека. К примерам лентивирусов относятся вирус иммунодефицита человека 1 (Human immunodeficiency virus 1), вирус висна (Visna virus) и вирус инфекционной анемии лошадей (Equine infectious anemia virus).
Подсемейство Spumaretrovirinae
Подсемейство Spumaretrovirinae имеет уникальную морфологию по сравнению с другими ретровирусами. Под электронной микроскопией они характеризуются «пенящимся» видом с обильными цитоплазматическими вакуолями.
В отличие от большинства представителей ретровирусов геном Spumavirinae представляет собой двухцепочечную ДНК, но также включает обратную транскрипцию как этап жизненного цикла.
Spumaretrovirinae обычно считаются менее патогенными, чем некоторые другие ретровирусы. Для них часто характерны стойкие бессимптомные инфекции у их естественных хозяев, в том числе приматов, не относящихся к человеку, и некоторых других млекопитающих. Известно 4 рода Spumaretrovirinae, включающих по одному виду – Bovispumavirus, Equispumavirus, Felispumavirus, Prosimiispumavirus; и ещё 1 род – Simiispumavirus, насчитывающий 15 видов.
Структура ретровирусов и строение генома
Структура ретровирусов играет ключевую роль в их способности инфицировать клетки-хозяева и персистировать в организме-хозяине.
Вирион имеет форму икосаэдра (20-гранника) и диаметр 80−100 нм и состоит из липидной оболочки, капсида, нуклеопротеинового комплекса, обратной транскриптазы, ферментов и РНК-генома.
Наружная липидная оболочка, которой вирус окружает себя при выходе из клетки-хозяина, покрыта ворсинками длиной 8−10 нм.
Капсид ретровирусов состоит из гликопротеинов и имеет 2 субъединицы: поверхностную, которая отвечает за связывание со специфическими рецепторами на поверхности клеток-хозяев, и трансмембранную, которая облегчает слияние мембран вируса и клетки-хозяина. Гликопротеины оболочки ретровирусов сильно гликозилированы, что помогает защитить вирус от иммунной системы хозяина.
Специфические взаимодействия между белками оболочки ретровируса и рецепторами клетки-хозяина определяют тропизм вируса. Ретровирусы могут инфицировать разные типы клеток, например Т-клетки (ВИЧ) или гемопоэтические клетки (ретровирусы, вызывающие лейкемию).
Ретровирусы имеют геном, состоящий из одноцепочечной РНК. Эта молекула РНК несёт всю генетическую информацию, необходимую вирусу для репликации и производства новых вирусных частиц. Таких молекул в вирионе две.
К основным генам ретровирусной РНК относятся: групповой антиген (gag), который кодирует структурные белки, образующие ядро вируса, включая капсид, нуклеокапсид и матричные белки; pol, который кодирует ферменты, необходимые для репликации и обработки вирусного генома, включая обратную транскриптазу, интегразу и протеазу; гены оболочки (env), которые кодируют гликопротеины оболочки, ответственные за связывание с рецепторами клетки-хозяина и опосредование проникновения в клетки-хозяева.
В зависимости от типа ретровируса могут существовать дополнительные гены, выполняющие различные функции, например регуляторные гены, контролирующие экспрессию вирусных генов, или вспомогательные гены, усиливающие репликацию вируса.
Жизненный цикл ретровирусов.
Жизненный цикл ретровируса включает связывание вирусной частицы и клетки-хозяина, проникновение вирусного генетического материала, обратную транскрипцию вирусной РНК, интеграцию провирусной ДНК в геном хозяина, транскрипцию и экспрессию генома, сборку вирусных частиц и выход вириона из клетки-хозяина.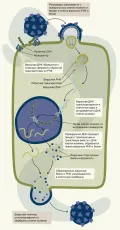
Жизненный цикл начинается, когда гликопротеины вирусной оболочки связываются со специфическими рецепто-рами на поверхности клетки-хозяина.

После связывания ретровирус проникает в клетку-хозяина посредством слияния мембран, чему способствуют конформационные изменения белков оболочки.
Попав в клетку-хозяина, геном ретровирусной РНК обратно транскрибируется в ДНК с помощью вирусного фермента обратной транскриптазы. Полученная вирусная кДНК (комплементарная ДНК)образует двухцепочечную молекулу ДНК, известную как провирусная ДНК. Провирусная ДНК транспортируется в ядро клетки-хозяина и с помощью вирусного фермента интегразы интегрируется в геномную ДНК клетки-хозяина. Эндогенные ретровирусы встречаются у разных видов животных, например, известно, что проретровирусы составляют до 5–8 % генома человека.
Интегрированная провирусная ДНК служит матрицей для транскрипции РНК-полимеразой клетки-хозяина. Вирусная РНК может транслироваться рибосомами клетки-хозяина для производства вирусных белков, необходимых для сборки новых вирусных частиц.
Структурные белки ретровирусов, такие как капсидные белки, синтезируются в клетке-хозяине и транспортируются к плазматической мембране, где они собираются с вирусной РНК для образования новых вирусных частиц.
Белки вирусной оболочки встраиваются в мембрану клетки-хозяина и впоследствии отпочковываются от клетки, приобретая при этом липидную оболочку. Высвободившиеся вирусные частицы могут инфицировать другие клетки-хозяева и начать цикл заново.
Простые и сложные ретровирусы
Ретровирусы принято разделять на простые и сложные, отличающиеся друг от друга строением, способностью вызывать разный спектр заболеваний, а также способностью избегать клеточный ответ в организме-хозяине. Простые и сложные ретровирусы имеют сферическую или палочковидную формы.
Простые ретровирусы, такие как вирус саркомы Рауса и вирус лейкоза мышей (Murine leukemia virus), имеют базовую геномную структуру с тремя основными генами (gag, pol, env) и простыми жизненными циклами. Простые ретровирусы часто имеют более ограниченный тропизм, поражая единичные типы клеток внутри своего вида-хозяина.
Сложные ретровирусы, примером которых является ВИЧ, имеют более широкий набор генов. Помимо основных генов gag, pol и env, ВИЧ, например, имеет такие гены, как tat (который кодирует трансактиватор, связанный с клеточными факторами, повышающими эффективность трансляции клеточной РНК-полимеразы, главным образом за счёт преждевременной остановки транскрипции), rev (ген кодирует белок, который связан с удлинением РНК транскриптов и их перемещением из ядра в цитоплазму), nef (ген, который не требуется для репликации вируса в культуре лимфоцитов, но важен для репликации в макрофагах и при развитии болезни, вызванной вирусом иммунодефицита обезьян у макак-резус), vif [ген кодирует белок (фактор инфекционности вирусов), который необходим для некоторых стадий вирусного морфогенеза, связанных с инфекционностью], vpr (способствует созреванию вирусных гликопротеинов в лентивирусах приматов) и vpu (слабый активатор транскрипции в лентивирусах приматов).
Сложные ретровирусы обладают более широким диапазоном клеточного тропизма. Они могут инфицировать различные типы клеток, включая CD4+ Т-клетки, макрофаги, дендритные клетки и др. Они развили механизмы уклонения от иммунных реакций хозяина, например с помощью белка nef. Сложные ретровирусы могут развивать устойчивость к антиретровирусным препаратам за счёт накопления мутаций в различных генах, включая обратную транскриптазу и протеазу.
БАКТЕРИОФАГИ.
Строение бактериофагов
[править | править код]

Бактериофаги различаются по химической структуре, типу нуклеиновой кислоты, морфологии и характеру взаимодействия с бактериями. По размеру фаги в сотни и тысячи раз меньше микробных клеток.
Типичная фаговая частица (вирион) состоит из головки и хвоста. Длина хвоста обычно в 2—4 раза больше диаметра головки. В головке содержится генетический материал — одноцепочечная или двуцепочечная РНК или ДНК с ферментом транскриптазой в неактивном состоянии, окружённая белковой или липопротеиновой оболочкой — капсидом, сохраняющим геном вне клетки.
Нуклеиновая кислота и капсид вместе составляют нуклеокапсид. Бактериофаги могут иметь икосаэдральный капсид, собранный из множества копий одного или двух специфичных белков. Обычно углы состоят из пентамеров белка, а опора каждой стороны из гексамеров того же или сходного белка. Более того, фаги по форме могут быть сферические, лимоновидные или плеоморфные.
Хвост, или отросток, представляет собой белковую трубку — продолжение белковой оболочки головки, в основании хвоста имеется АТФаза, которая регенерирует энергию для инъекции генетического материала. Существуют также бактериофаги с коротким отростком, не имеющие отростка и нитевидные.
Головка округлой, гексагональной или палочковидной формы диаметром 45—140 нм. Отросток толщиной 10—40 и длиной 100—200 нм. Одни из бактериофагов округлы, другие нитевидны, размером 8×800 нм. Длина нити нуклеиновой кислоты во много раз превышает размер головки, в которой находится в скрученном состоянии, и достигает 60—70 мкм. Отросток имеет вид полой трубки, окружённой чехлом, содержащим сократительные белки, подобные мышечным. У ряда вирусов чехол способен сокращаться, обнажая часть стержня. На конце отростка у многих бактериофагов имеется базальная пластинка, от которой отходят тонкие длинные нити, способствующие прикреплению фага к бактерии. Общее количество белка в частице фага — 50—60 %, нуклеиновых кислот — 40—50 %[17].
Фаги, как и все вирусы, являются внутриклеточными паразитами, и не способны к самостоятельному размножению. Хотя они содержат всю информацию для запуска собственной репродукции в соответствующем хозяине, у них нет механизмов для выработки энергии и рибосом для синтеза белка. Размер известных фаговых геномов варьирует от нескольких тысяч до 498 тысяч пар оснований (геном фага G, поражающего бацилл). В метагеномных исследованиях описывали фаговые геномы длиной до 735 т. п. о.
Классификация бактериофагов
Большое количество выделенных и изученных бактериофагов определяет необходимость их систематизации. Этим занимается Международный комитет по таксономии вирусов (ICTV). В настоящее время, согласно Международной классификации и номенклатуре вирусов, бактериофаги разделяют в зависимости от типа нуклеиновой кислоты и морфологии.
На данный момент выделяют девятнадцать семейств. Из них только два РНК-содержащих и только пять семейств имеют оболочку. Из семейств ДНК-содержащих вирусов только два семейства имеют одноцепочечные геномы. У девяти ДНК-содержащих семейств геном представлен кольцевой ДНК, а у других девяти — линейной. В 2000 году считалось, что девять семейств специфичны только для бактерий, остальные девять только для архей, а представители семейства Tectiviridae инфицируют как бактерий, так и архей[21].
Жизненный цикл
По характеру взаимодействия бактериофага с бактериальной клеткой различают вирулентные и умеренные фаги[16]. Вирулентные фаги могут увеличиваться в количестве только посредством литического цикла[23]. Умеренные бактериофаги после деления клетки находятся в состоянии профага (лизогенный цикл).
Начальные этапы взаимодействия с бактериальной клеткой одинаковы для умеренных и вирулентных бактериофагов. Бактериофаги прикрепляются к фагоспецифическим рецепторам на поверхности бактериальной клетки. Хвост фага с помощью ферментов, находящихся на его конце (в основном лизоцима), локально растворяет оболочку клетки, сокращается и содержащаяся в головке ДНК инъецируется в клетку, при этом белковая оболочка бактериофага остаётся снаружи.
При инициации литического цикла инъецированная ДНК вызывает полную перестройку метаболизма клетки: прекращается синтез бактериальной ДНК, РНК и белков. Нуклеиновая кислота фага реплицируется. Репликация ДНК бактериофага происходит по полуконсервативному механизму и осуществляется с участием собственных ДНК-полимераз. ДНК бактериофага начинает транскрибироваться с помощью собственного фермента транскриптазы, который после попадания в бактериальную клетку активируется. Синтезируются сначала ранние, а затем поздние мРНК, которые поступают на рибосомы клетки-хозяина, где синтезируются, соответственно, ранние (ДНК-полимеразы, нуклеазы) и поздние белки бактериофага (белки капсида и хвостового отростка, ферменты лизоцим, АТФаза и транскриптаза). После синтеза поздних белков и завершения репликации ДНК наступает заключительный процесс — созревание фаговых частиц или соединение фаговой ДНК с белком оболочки и образование зрелых инфекционных фаговых частиц[24]. Продолжительность этого процесса может составлять от нескольких минут до нескольких часов[23]. Затем происходит лизис клетки, и освобождаются новые зрелые бактериофаги[16].
При инициации лизогенного цикла генетический материал фага обратимо взаимодействует с генетической системой клетки-хозяина, интегрируясь в хромосому или сохраняясь в виде плазмиды[23]. Таким образом, вирусный геном реплицируется синхронно с ДНК хозяина и делением клетки, а бактериофаг в подобном состоянии называется профагом. Бактерия, содержащая профаг, становится лизогенной до тех пор, пока при определённых условиях или спонтанно профаг не будет стимулирован на осуществление литического цикла. Переход от лизогении к лизису называется лизогенной индукцией, или индукцией профага[25]. На индукцию фага оказывает сильное воздействие состояние клетки хозяина, предшествующее индукции, также как наличие питательных веществ и другие условия, имеющие место в момент индукции. Скудные условия для роста способствуют лизогенному пути, тогда как хорошие условия способствуют лизирующей реакции[23][16][24]. Известны случаи спонтанной индукции. Умеренные фаги из семейства Inoviridae способны стабильно воспроизводиться, не вызывая гибели клеток хозяина[
Роль бактериофагов в биосфере
Бактериофаги представляют собой наиболее многочисленную, широко распространённую в биосфере и, предположительно, наиболее эволюционно древнюю группу вирусов[2][15][34]. В природных условиях фаги встречаются в тех местах, где есть чувствительные к ним бактерии, причем в некоторых экосистемах, например в водоемах, численность фаговых частиц превышает численность бактерий в 2—10 раз[источник не указан 407 дней]. Как правило, чем богаче тот или иной субстрат (почва, выделения человека и животных, вода и т. д.) микроорганизмами, тем в большем количестве в нём встречаются соответствующие фаги, но имеются и исключения[источник не указан 407 дней]. Приблизительный размер глобальной популяции фагов составляет более 1030 фаговых частиц[35]. Бактериофаги контролируют численность микробных популяций, и в водных местообитаниях косвенно измеряемый вклад фаговой инфекции в суточную смертность бактерий составляет 10—20 %[36][37]. Помимо этого, они осуществляют горизонтальный перенос наследственного материала, привнося в бактериальный геном новые гены или новые варианты имеющихся генов. Такой перенос может осуществляться посредством трансдукции или лизогенной конверсии[38][39].
Поскольку фаги, как правило, узкоспецифичны по отношению к хозяевам, абсолютная концентрация микробных клеток каждого штамма и активных против них бактериофагов может быть низкой (хотя общая концентрация всех бактерий и всех фагов может быть достаточно высока[2][40]. В результате, в перемешиваемых системах действует механизм kill-the-winner (убить победителя). В соответствии с ним давление фаговой инфекции на конкретную бактериальную популяцию возрастает по мере роста ее плотности. То есть, фаги вносят больший вклад в смертность экологически более успешных видов и штаммов по сравнению с минорными популяциями[2][40]. Более того, при лизисе бактериальной клетки бактериофагом большая часть биомассы бактерии преобразуется в мелкодисперсное растворимое органическое вещество, служащее питанием для других гетеротрофных бактерий. В результате фаговая инфекция не только ограничивает размножение наиболее приспособленных видов, но и перераспределяет органическое вещество. По существующим моделям до 26 % всего объема первичной продукции органического вещества в морских экосистемах поступает в пул растворённого органического вещества в результате вирусного (в основном фагового) лизиса клеток различных организмов. Таким образом, фаговая инфекция поддерживает разнообразие бактерий и стимулирует их метаболическую активность, по меньшей мере в некоторых экосистемах. В микробных сообществах, ассоциированных с продуцирующими слизь тканями животных, например, на коралловых рифах или в кишечнике млекопитающих, высокая численность бактерий способствует переходу умеренных фагов в лизогенное состояние, и лизогенная конверсия преобладает над литическим циклом. Следствиями этого являются повышенная устойчивость лизогенов к фаговой инфекции и преимущественное размножение фагов наиболее многочисленных бактерий, не сопровождающееся их гибелью. Такие отношения между вирусами и бактериями описываются моделью piggyback-the-winner (оседлать победителя)[41][42]. Для описания взаимодействия бактериальной и фаговой популяций также используют модели kill-the-competitor (убить конкурента), arms-race dynamics (динамика гонки вооружений) и fluctuating-selection dynamics (динамика флуктуирующего отбора)[43].
Бактериофаги присутствуют в значительных количествах и в наземных экосистемах. Так, фаги, лизирующие клетки различных видов почвенных микроорганизмов, находятся в почвах. Особенно[прояснить] богаты фагами чернозёмы и почвы, в которые вносились органические удобрения[источник не указан 407 дней]. Вирусные сообщества (виромы), состоящие почти целиком из бактериофагов, ассоциированны и с микробиомом тела человека и животных, особенно многочисленны и разнообразны виромы кишечника[прояснить][44]. Предполагают, что виром кишечника играет существенную роль в гомеостазе макроорганизма[уточнить] и в патогенезе некоторых заболеваний[уточнить].
Высокий уровень специализации, долгосрочное существование, способность быстро репродуцироваться в соответствующем хозяине способствует их сохранению в динамичном балансе среди широкого разнообразия видов бактерий в любой природной экосистеме. Когда подходящий хозяин отсутствует, многие фаги могут сохранять способность к инфицированию на протяжении десятилетий[23], однако в реальных экосистемах срок полужизни вирусных частиц составляет от нескольких часов до нескольких суток. Фаговые частицы инактивируются ультрафиолетовым облучением, могут необратимо связываться с различными частицами, гибнут в результате непродуктивной инфекции физиологически неактивных или мертвых клеток бактерий, могут выедаться некоторыми видами простейших, разрушаются под действием многих иных факторов. В большинстве случаев суточная продукция фаговых частиц уравновешивается их разрушением
Применение
[править | править код]
В биологии
[править | править код]
Бактериофаги применяются в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция).
Фаговые векторы обычно создают на базе умеренного бактериофага λ, содержащего двухцепочечную линейную молекулу ДНК. Левое и правое плечи фага имеют все гены, необходимые для литического цикла (репликации, размножения). Средняя часть генома бактериофага λ (содержит гены, контролирующие лизогению, то есть его интеграцию в ДНК бактериальной клетки) не существенна для его размножения и составляет примерно 25 тысяч пар нуклеотидов. Данная часть может быть заменена на чужеродный фрагмент ДНК. Такие модифицированные фаги проходят литический цикл, но лизогения не происходит. Векторы на основе бактериофага λ используют для клонирования фрагментов ДНК эукариот (то есть более крупных генов) размером до 23 тысяч пар нуклеотидов (т. п. н.). Причём, фаги без вставок — менее 38 т. п. н. или, напротив, со слишком большими вставками — более 52 т. п. н. не развиваются и не поражают бактерии[46].
Бактериофаги M13, фаг Т4, T7 и фаг λ используют для изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий методом фагового дисплея.
Поскольку размножение бактериофага возможно только в живых клетках, бактериофаги могут быть использованы для определения жизнеспособности бактерий, например, с помощью метода электрооптического анализа клеточных суспензий[47].
В медицине
[править | править код]
Основная статья: Фаготерапия
Одной из областей использования бактериофагов является антибактериальная терапия, самостоятельная или как дополнение к приёму антибиотиков. Применение бактериофагов в терапевтических целях затруднено их высокой специфичностью, но оправдано при инфекциях, осложнённых антибиотикорезистентностью или развитием биоплёнок[48]. По состоянию на 2000 год терапевтическое применение бактериофагов не имело одобрения на Западе, однако в различных странах имеет место процесс развития соответствующих правовых норм. С 2018 года в Бельгии фаги производятся в рамках концепции магистральных препаратов на основании разрешений, выдаваемых сертифицированным национальным лабораториям, и применяются под прямой ответственностью врачей и фармацевтов[49]. В 2020 году фаготерапия пневмонии и бактериемии, обусловленных антибиотикорезистентными штаммами Acinetobacter baumannii, Pseudomonas aeruginosa и Staphylococcus aureus, получила одобрение FDA[50]. За пределами исторического Восточного блока центры фаготерапии функционируют в Бельгии[51], Израиле[52] и США[53]. Доля трудноизлечимых инфекций, при которых наблюдалось клиническое улучшение после курса фаготерапии, была оценена в 79 %. Эрадикация возбудителей была достигнута в 87 % опубликованных случаев[54].
Фаговые препараты используются для профилактики заболеваний[55]. Также существует практика обработки пищевых продуктов для уничтожения бактерий, вызывающих пищевые отравления, таких как листерии[56].
В растениеводстве
[править | править код]
Бактериофаги могут быть использованы для борьбы с важными для сельского хозяйства патогенами растений. Показана их применимость для обработки растений до сбора урожая и в послеуборочной обработке продукции. Для повышения эффективности и предотвращения развития резистентности у бактериального хозяина используются высокие титры литических фагов. Препятствием применения фаговых препаратов для защиты растений является чувствительность фаговых частиц к ультрафиолету. Для увеличения продолжительности жизни фагов в филлосфере фаги могут быть нанесены вечером. Устойчивую популяцию фагов на поверхности листьев можно создать путём использования различных вспомогательных препаратов, таких как обезжиренное молоко, смешанных с растворами фагов. Также возможно использование непатогенных бактерий-носителей, обеспечивающих размножение и выживание фагов на поверхности растений[57]. В экспериментах по оценке эффективности бактериофагов для защиты картофеля был показан пятикратный прирост урожайности[
4. ВИЧ,
гепатит человека.
5. Бактерии.
Общая характеристика.
Понятие штамм.
6. Вирусы и бактерии: сходства и различия.
Вирусные и бактериальные заболевания. —
изучение общих принципов использования лекарственных веществ, особенности применения антибиотиков; «Вирусные заболевания человека»,
«Ветряная оспа»,
«Грипп»«Герпес»,
«Вирус папилломы человека (ВПЧ),
«Бактерии: разнообразие, роль в жизни человека»,
«Туберкулез», «Холера» и др.


0 Комментариев