ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ и ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ.
Химическая промышленность -отрасль народного хозяйства, производящая продукцию на основе химической переработки сырья.
Основой химического производства является химическая технология — это наука о наиболее экономичных методах и средствах массовой химической переработки сырья (природных материалов) в продукты потребления и промежуточные продукты, применяемые в различных отраслях народного хозяйства. Слово технология образовано из греческих корней технос — «мастерство», «искусство» и логос — «наука», учение. Химическая технология непосредственно связана с химией.
Химическая технология — наука о способах производства промышленных продуктов посредством химических реак-ций.
Главная задача химической технологии — производство разнообразных веществ и материалов с определённым комплексом заданных механических, физических, химических или биологических свойств.
Знание общих закономерностей протекания химических реакций позволяет правильно определить условия, при которых тот или иной процесс протекает с максимальным выходом.
Оглавление
- 1 ХИМИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ и ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ.
- 1.1 ИСТОРИЯ РАЗВИТИЯ ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ.
- 1.2 СТРУКТУРА ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ.
- 1.3 ГЕОГРАФИЧЕСКОЕ РАСПОЛОЖЕНИЕ ОСНОВНЫХ ПРОМЫШЛЕННЫХ ЗОН РОССИИ.
- 1.4 ОБЩИЕ ПРИНЦИПЫ ОРГАНИЗАЦИИ ХИМИЧЕСКИХ ПРОИЗВОДСТВ.
- 1.5 ТЕХНОЛОГИЧЕСКИЕ СОСТАВЛЯЮЩИЕ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА.
- 1.6 ФАКТОРЫ, ВЛИЯЮЩИЕ НА РАЗМЕЩЕНИЕ ХИМИЧЕСКИХ ПРОИЗВОДСТВ.
- 1.7 СЫРЬЁ ДЛЯ ХИМИЧЕСКИХ ПРОИЗВОДСТВ. КЛАССИФИКАЦИЯ СЫРЬЯ.
- 1.8 ХАРАКТЕРИСТИКА ПРОДУКТОВ ХИМИЧЕСКОГО ПРОИЗВОДСТВА.
- 2 НАУЧНЫЕ ПРИНЦИПЫ ОРГАНИЗАЦИИ ХИМИЧЕСКОГО ПРОИЗВОДСТВА.
- 3 ТЕХНОЛОГИЯ ОСНОВНОГО НЕОРГАНИЧЕСКОГО СИНТЕЗА.
ИСТОРИЯ РАЗВИТИЯ ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ.
Химическая промышленность выделилась в отдельную отрасль с началом промышленного переворота. Первые заво-ды по производству серной кислоты — важнейшей из минеральных кислот, применяемых человеком, были построе-ны в 1740 г. в Великобритании (Ричмонд), в 1766 г. во Франции (Руан), в 1805 г. в России (Подмосковье), в 1810 г. в Германии (Лейпциг).
Для обеспечения потребностей развивающихся текстильной и стекольной промышленности возникло производство кальцинированной соды. Первые содовые заводы появились в 1793 г. в Париже (Франция), в 1823 г. — в Ливерпуле (Великобритания), в 1843 г. — в г. Шёнебек-на-Эльбе (Германия), в 1864 г. — в Барнауле (Россия). С развитием в сере-дине XIX в. сельского хозяйства появились заводы искусственных удобрений: в 1842 г. в Великобритании, в 1867 г. в Германии, в 1892 г. в России.
Сырьевые связи и раннее возникновение индустрии способствовали становлению Великобритании как мирового лидера в химическом производстве на протяжении трёх четвертей XIX в. С конца XIX в. С ростом потребности эконо-мики в органических веществах лидером в химической промышленности становится Германия. Благодаря быстрому процессу концентрации производств, высокому уровню научно-технического развития, активной торговой политике Германия к началу XX в. завоёвывает мировой рынок химической продукции.
В США химическая промышленность начала развиваться позже, чем в Европе, но уже к 1913 г. по объёму производ-ства химической продукции США заняли и с тех пор удерживают 1–е место в мире среди всех государств. Этому спо-собствуют богатейшие запасы полезных ископаемых, развитая транспортная сеть, мощный внутренний рынок. Лишь к концу 80–х годов химическая индустрия стран ЕС в общем исчислении превысила объёмы производства в США.
СТРУКТУРА ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ.
Химический комплекс России является базовым сегментом экономики. Химическая промышленность имеет сложный многоотраслевой состав. Традиционно она подразделяется на горнохимическую отрасль (производит добычу и пер-вичную переработку химического сырья — апатитов, фосфоритов, серы, каменных солей, нефти, газа, угля); основное химическое производство и производство (переработку) резиновых и пластмассовых изделий (использует пластики и каучуки в качестве полуфабрикатов).
Основное химическое производство включает:
- производство основных химических веществ или химию органического синтеза (удобрений, синтетического каучука, пластмасс и синтетических смол и др.);
- производство ПАВ (поверхностно-активных веществ);
- производство фармацевтической продукции;
- производство красок;
- производство искусственных и синтетических волокон;
- производство химических средств защиты растений.
Существует и несколько иная классификация химического производства, включающая помимо горно-химической отрасли основную химию, химию органического синтеза (производство основных органических веществ), химико-фармацевтическую промышленность и производство товаров бытовой химии.
В данной классификации производство синтетических волокон, а также лаков и красок относится к химии органи-ческого синтеза.
Разделение химического производства по отраслям является достаточно условным, поскольку многие современные предприятия-холдинги производят разные виды продукции с целью комплексного использования сырья.
Наибольшим масштабом отличаются производства основных неорганических веществ: серной , азотной и фосфор-ной кислот, аммиака , азота и кислорода , негашёной извести , едкого натра , газообразного хлора и хлороводоро-да . Эти вещества используют в больших количествах, в том числе для получения пластмасс, синтетических волокон, лекарств, удобрений, моющих средств, парфюмерии, косметики, пищевых продуктов.
Отраслью химической промышленности является нефтехимическая промышленность, которая охватывает произ-водство синтетических материалов и изделий на основе продуктов переработки природных горючих газов и нефти. На предприятиях нефтехимической промышленности производятся продукты основного органического синтеза (пропилен, этилен, полиэтилен, моющие средства, поверхностно-активные вещества (ПАВ), некоторые виды мине-ральных удобрений), синтетический каучук, резиновые изделия (резинотехнические изделия, автопокрышки, предметы широкого потребления), асбестотехнические изделия, сажа.

Любое химическое производство создается и функционирует на основе научных принципов организации производст-ва.
ГЕОГРАФИЧЕСКОЕ РАСПОЛОЖЕНИЕ ОСНОВНЫХ ПРОМЫШЛЕННЫХ ЗОН РОССИИ.
Главные предприятия химической промышленности расположены в четырёх промышленных регионах России:
- Центральный (вокруг Москвы), здесь развиты все виды химии и используется в основном привозное сырьё. В регионе наблюдается дефицит энергетических и водных ресурсов, зато располагается крупный и разнообра-зный потребитель. На территории региона производят фосфорные удобрения (г. Воскресенск), сложные удоб-рения (Московская и Тульская области). Центральный регион специализируется на производстве полимерных материалов и их переработке. Крупные центры – Ярославль и Санкт-Петербург. Через территорию химической базы Центрального региона проходят крупные магистральные нефтепроводы. Здесь расположены крупные нефтеперерабатывающие заводы (Москва, Ярославль, Рязань, Кстово, Йошкар-Ола). Центральная база является своего рода полигоном для апробации новых материалов и создания новых технологий.
- Урало-Поволжский, здесь особенно развита основная химия (производство минеральных удобрений в Соликамс-ке и Березниках, производство азотных удобрений, синтетических смол и пластмасс, синтетического каучука в Саратовской области). Регион имеет выгодное географическое положение, собственные запасы ресурсов, бога-тые водные ресурсы и гидроэнергетические ресурсы Волго-Камского каскада гидроэлектростанций.
- Северо-Европейский регион даёт только 3% в общероссийском производстве продукции, но имеет крупные запа-сы химического сырья: угля, нефти, природного газа и апатитов, имеет выгодное географическое положение, хорошо обеспечен водой и энергией. Ведущей отраслью здесь является горно-химическая, налажено производ-ство апатитового концентрата, который используются для производства фосфорных удобрений. Здесь также имеются широкие возможности для химии органического синтеза.
- Сибирский регион сформировался на базе нефтехимической промышленности Тобольска, Томска, Ангарска, Омска. Углехимическая промышленность располагается в Черемхово и Кемерово, полимерная химия — в Красноярске и Барнауле, производство соли — в Усолье-Сибирском.
ОБЩИЕ ПРИНЦИПЫ ОРГАНИЗАЦИИ ХИМИЧЕСКИХ ПРОИЗВОДСТВ.
К основным принципам организации химических производств относятся:
— создание оптимальных условий проведения химических реакций: выбор температурного режима, давления, катали-заторов, которые значительно увеличивают скорость химической реакции. На некоторых конкретных производствах возможны частные принципы: принцип противотока веществ; принцип прямотока веществ; увеличение поверхности соприкосновения реагирующих веществ;
— полное и комплексное использование сырья: циркуляция, получение офлюсованных агломератов (производство чугуна и стали), безотходное производство и т. п.;
— использование теплоты химических реакций: принцип теплообмена, утилизация теплоты реакций в нуждах произ-водства и местности;
— принцип непрерывности: обеспечение полной автоматизации механизаций, компьютеризации;
— защита окружающей среды и человека: автоматизация вредных производств, герметизация аппаратуры, утили-зация отходов производства, нейтрализация выбросов в атмосферу.
ТЕХНОЛОГИЧЕСКИЕ СОСТАВЛЯЮЩИЕ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА.
1) Аппаратура — технологическое оборудование для осуществления обработки сырья и утилизации отходов, а также осуществления всех этапов получения самого продукта производства. Аппаратура устанавливается стационарно и работает в течение определённого срока допуска.
2) Сырьё — это либо природный материал, не прошедший химической обработки, но используемый для получения различных продуктов, либо полученный в химическом производстве продукт. Сырьём могут быть отходы произ-водств, а также изделия, отслужившие свой срок.
3) Вторичное сырьё — кроме природных веществ на химических заводах применяют вторичное сырьё: полупродукты и отходы производства. Химия использует отходы многих производств, поэтому важным фактором её размещения яв-ляется комбинирование производства, особенно с металлургией. Возможности комбинирования и использования разнообразного сырья так велики, что позволяют строить предприятия химической промышленности почти повсеме-стно. Но это нецелесообразно из-за высокой энерго- и водоёмкости производств.
4) Вспомогательные материалы: вода, топливо, окислители, растворители, катализаторы.
Вода играет очень важную роль в химическом производстве. В некоторых процессах она выполняет роль образующей среды — то есть используется для приготовления растворов и взвесей (например, пульпы при обогащении полезных ископаемых), в других химических процессах вода выполняет роль реагента, участвующего в химических реакциях (например, в реакции гидролиза). Вода хороший теплоноситель, так как обладает большой теплоёмкостью (процессы теплообмена). Холодной водой охлаждают реагирующие массы, нагретые в результате экзотермических реакций, а горячим водяным паром или горячей водой подогревают взаимодействующие вещества для ускорения реакций, особенно эндотермических.
Величина, характеризующая затраты ресурсов (воды, сырья, энергии) на производство единицы продукции, называе-тся ресурсоёмкостью производства.
Водоёмкость производства — частный случай ресурсоёмкости. Расход воды на современных предприятиях огромен. Например, чтобы получить 1 т аммиака, требуется 1500 куб. м воды. Поэтому все предприятия строятся рядом с вод-ными источниками. Одна из главных задач современного производства — сокращение объёмов потребления чистой воды за счёт создания систем оборотного водоснабжения. Это возможно сделать, если образующиеся сточные воды производства охладить и очистить на современных охлаждающих и очистных установках. В результате сокращается потребление воды и предотвращается сброс опасных отходов. В некоторых технологических операциях можно также заменить водяное охлаждение на воздушное.
5) Энергия. Большинство химических процессов требует затрат энергии. Она расходуется на транспортировку сырья и готовой продукции, сжатие газов, дробление твёрдых веществ, работу контрольно-измерительных приборов, проте-кание эндотермических реакций.
Величина, характеризующая затраты энергии на единицу выпускаемой продукции, называется энергоёмкостью производства.
Например, на производство 1 т аммиака требуется 3200 кВт/ч электроэнергии, а на производство 1 т алюминия — 1900 кВт/ч. Значит, производство аммиака является более энергоёмким, чем производство алюминия. Энергоёмкость — также частный случай ресурсоёмкости.
В химической промышленности используют электрическую, тепловую, ядерную, химическую и световую энергию. Электрическую энергию используют для проведения электролиза расплавов и растворов веществ, нагревания, в операциях, связанных с электростатическими явлениями. Электроэнергию вырабатывают ТЭС, АЭС, ГЭС. Тепловая энергия необходима для нагрева реагирующих веществ, для сушки, плавления, дистилляции, выпаривания и др. Ядерную энергию, главным образом, используют для получения электроэнергии. Но такие реакции, как полимери-зация, синтезы фенолов и анилина проводят с помощью радиоактивного излучения. Химическая энергия выделяется в виде теплоты в результате экзотермических реакций. Её используют для предварительного подогрева исходных веществ, получения горячей воды, водяного пара. При получении 1 т серной кислоты из серы выделяется 5 МДж теплоты, а общие затраты на её производство составляют всего 0,36 МДж. Излишки поступают к другим потребителям в виде пара и электроэнергии. Световую энергию (ультрафиолетовое, инфракрасное, лазерное излучение) используют при синтезе хлороводорода, галогенировании органических веществ, реакциях изомеризации.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА РАЗМЕЩЕНИЕ ХИМИЧЕСКИХ ПРОИЗВОДСТВ.
Месторасположение любого производства определяют следующие факторы:
- сырьевые;
- ресурсные (водный, топливно-энергетический, трудовой);
- потребительские;
- инфраструктурные;
- экологические.
В отличие от реакций, проводимых в лабораториях, многотоннажное промышленное производство в первую очередь ориентировано на получение прибыли. Поэтому очевидно, что при строительстве новых предприятий или реконст-рукции уже функционирующих производств определяющими являются экономические факторы, к которым отно-сятся факторы обеспечения сырьём и ресурсами (водными, энергетическими, трудовыми), инфраструктурный и пот-ребительский. Именно эти факторы определяют рентабельность производства, поскольку влияют на стоимость продукции.
На размещение химических предприятий большое влияние оказывает стоимость перевозок, затраты на топливо, воду и электроэнергию. Именно поэтому, например, электролитические производства, потребляющие большое количество электроэнергии (энергоёмкие производства), располагают вблизи гидроэлектростанций, доменные печи – рядом с месторождениями железной руды и каменного угля, а потребляющие большие объёмы воды (ресурсоёмкие производства) — рядом с реками или водохранилищами.
Потребительские факторы также оказывают влияние на размещение химических производств, продукция которых может быть опасна при транспортировке (кислоты, щёлочи), или потребляется в конкретных районах (например, удобрения или ядохимикаты). Этот же фактор важен для отраслей, производящих продукцию, перевозка которой обходится дороже, чем перевозка сырья для её изготовления (шины, изделия из пластмасс).
Инфраструктурные факторы включают наличие инженерных коммуникаций (автодорог, электросетей, канализации и водопровода и др.) и обеспечивают стабильное функционирование самого производства и связь его с поставщиками сырья и потребителями готовой продукции.
Все экономические факторы взаимосвязаны и представляют собой логистику управления производством.
Логистика — это управление всеми процессами движения сырья, материалов, товаров и продуктов на производство, внутри производства и из производства.
При функционировании производства необходимо обязательно учитывать экологические факторы. Все предприятия химической отрасли промышленности относится к опасным видам производств, так как оказывают негативное воздей-ствие на все компоненты окружающей среды. При функционировании любого промышленного предприятия образу-ются отходы — газовоздушные выбросы, сточные воды и твёрдые промышленные отходы. После необходимого обез-вреживания газы выбрасывают в атмосферу, жидкие отходы сбрасывают в канализацию, твёрдые и некоторые жид-кие горючие отходы сжигают в специальных печах или захоранивают на специально оборудованных полигонах твёр-дых промышленных отходов (ТПО). Отходы химических производств содержат вещества I–III классов опасности, поэто-му проблема обеспечения защиты окружающей среды от негативного воздействия производства должна решаться са-мим предприятием с использованием современных методов очистки образующихся газовоздушных выбросов и сточ-ных вод. Предприятие также несет ответственность за утилизацию образовавшихся твёрдых промышленных отходов.
СЫРЬЁ ДЛЯ ХИМИЧЕСКИХ ПРОИЗВОДСТВ. КЛАССИФИКАЦИЯ СЫРЬЯ.
Особенности сырьевой базы технологии неорганических веществ.
Основой сырьевой базы технологии неорганических веществ является первичное и вторичное минеральное сырье (необогащенное и обогащенное природное минеральное сырье, побочные продукты промышленного производства, вода, компоненты воздуха). В качестве водород- и углеродсодержащего сырья в неорганической технологии исполь-зуются природный и попутный газы, продукты переработки нефти, угля, древесины и т.д. Запасы минерального и других видов сырья определяются в результате постоянно ведущихся геологоразведочных работ. Запасы сырья ста-новятся промышленными тогда, когда достоверно известны объемы запасов, условия их залегания, определены промышленные характеристики этого сырья, разработана или реализована технология его добычи, обогащения, доставки потребителю и переработки в конечные продукты.
Сырьевая база технологии неорганических веществ России была сформирована за годы Советской власти. Большую роль в этом сыграла Комиссия по изучению естественных производительных сил России (КЕПС), которая была создана в 20-х гг. ХХ столетия при Академии наук Российской Федерации. В работе этой комиссии самое активное участие при-нимали академики Н.С. Курнаков, В.И. Вернадский, А.Е. Ферсман. Уже в 1925–26 гг. были открыты залежи калийных со-лей в Верхнекамском регионе, уникальное месторождение апатито-нефелиновых руд на Кольском полуострове.
Виды минерального сырья, используемого в технологии неорганических веществ (НТВ), в первую очередь определя-ются содержанием основного полезного элемента. Различают сырье водородсодержащее, азотсодержащее, калий-ное, натриевое, магниевое, фосфорное, фторсодержащее, хромовое, борсодержащее и т.п.
Классификация сырья.
Сырьё, используемое в промышленности, классифицируют по следующим признакам.
1. По агрегатному состоянию сырьё бывает:
- твёрдое (руды, горные породы, твёрдое топливо);
- жидкое (нефть, рассолы);
- газообразное (природный и попутные газы, воздух).
2. По составу сырьё делят на минеральное и органическое (растительное и животное).
- К минеральному сырью относят все виды руд, а также нерудные ископаемые: серу, фосфориты, калийные соли, поваренную соль, песок, глины, слюду (из них получают неметаллы, удобрения, соду, щёлочи, кислоты, керами-ку, цемент, стекло и др.).
- К органическому сырью относят горючие ископаемые: торф, уголь, нефть, природный и попутный нефтяной газ. К органическому сырью также относится также сырьё растительного и животного происхождения, которое поставляют сельское, лесное и рыбное хозяйства.
В зависимости от вида производимой продукции, сырьём для химической промышленности являются:
-отходы переработки сельскохозяйственной продукции (спирты, масла);
-минеральное сырьё (сера, фосфориты, соли);
-минеральное топливо (нефть, газ, уголь);
-растительное сырьё (отходы лесной промышленности, целлюлоза) -вода и воздух;
-отходы предприятий металлургии и нефтепереработки (коксовый газ, сернистый газ);
ХАРАКТЕРИСТИКА ПРОДУКТОВ ХИМИЧЕСКОГО ПРОИЗВОДСТВА.
По составу промышленные химические продукты делят на технические, химические реактивы и чистые и особо чис-тые химические вещества. Эта классификация определяет особенности технологии и области применения неоргани-ческих продуктов.
Важной классификацией промышленных неорганических продуктов является классификация, в основе которой лежат области применения продуктов. Неорганические продукты применяются:
-в качестве сырья в химической промышленности,
-в качестве вспомогательных материалов в разнообразных отраслях промышленности (химической, металлургичес-кой, текстильной, пищевой и др.),
-в качестве удобрений и вспомогательных веществ в сельском хозяйстве,
-в качестве продуктов потребления.
Область применения продукта диктует особенности технологии, которые определяют состав и качество продукта, эко-номические показатели производства продукта, объемы производства. По объему производства различают крупно-тоннажные, среднетоннажные и малотоннажные продукты.
Наиболее важной является классификация технологий неорганических веществ по технологическому признаку. С этой точки зрения технология неорганических веществ может быть разделена на следующие виды:
−технологию основного неорганического синтеза;
−технологию минеральных удобрений, солей и щелочей;
−технологию катализаторов и адсорбентов;
−технологию электротермических производств;
−технологию тонкого неорганического синтеза, химических реактивов и особо чистых веществ.
НАУЧНЫЕ ПРИНЦИПЫ ОРГАНИЗАЦИИ ХИМИЧЕСКОГО ПРОИЗВОДСТВА.
ОБЕСПЕЧЕНИЕ УСТОЙЧИВОГО РАЗВИТИЯ ОБЩЕСТВА.
В настоящее время перед человеческим сообществом стоит задача перехода к обществу устойчивого развития, в котором обеспечивались бы приемлемые для человека и природных экосистем условия существования. Эта задача исключительно сложна и предусматривает осуществление комплекса разноплановых и взаимосвязанных мероприятий, а именно:
- разумное ограничение потребностей человека;
- создание новых технических объектов и технологий, ориентированных на малоотходность и ресурсосбережение;
- обеспечение экологической безопасности производства за счёт минимизации его воздействия на человека и природную среду;
- рациональное взаиморазмещение производств и жилых зон.
Любое промышленное производство ставит своей задачей максимальное повышение производительности труда, то есть получение наибольшего количества продукта высокого качества с наименьшей себестоимостью. В химическом производстве это достигается путём осуществления целого ряда общих научных принципов.

Важнейшей задачей организации химического производства является подбор опти-мальных условий, при которых скорости химических реакций являются максималь-ными и при этом обеспечивается максимально возможный выход продукта реакции.
НАУЧНЫЕ ПРИНЦИПЫ ОРГАНИЗАЦИИ ХИМИЧЕСКОГО ПРОИЗВОДСТВА.
Каких научных принципов следует придерживаться при проведении технологического процесса обеспечивающего высокую скорость протекания химических реакций, высокий выход продукта реакции, а также позволяющего пре-дотвратить техногенное загрязнение окружающей среды.
1. С целью ускорения процесса любого химического производства требуется максимальное увеличение поверхности реагирующих веществ. Поэтому технологический процесс обычно начинается со специальной предварительной подготовки сырья: механического измельчения (дробления), обогащения и очистки. Измельчение сырья позволяет значительно увеличить скорость протекания химических реакций. Так, кусок антрацита (каменного угля) массой 1 кг может гореть в печи в течение трёх часов, а при его измельчении до порошкообразного состояния время сгорания составляет несколько секунд. Примерами типичных измельчающих устройств, используемых в быту, являются кофемолка, миксер или мясорубка.
2. Многие химические реакции являются экзотермическими, то есть протекают с выделением тепла. С другой сторо-ны, для инициирования многих реакций требуется нагрев до определённых температур. Для этого в производстве используют различные теплообменники, которые позволяют утилизировать тепло химических реакций. Роль тепло-носителя чаще всего выполняет вода. Использование тепла химических реакций в технологическом цикле называ-ется теплообменом и относится к технологическим принципам организации химического производства.
3. С целью обеспечения наиболее тесного контакта реагирующих веществ в химических производствах, помимо из-мельчения этих веществ, требуется также их перемещение относительно друг друга. Для этого используют принцип массообмена и его разновидности — противоток, поток реагирующих веществ в одном направлении и перемеши-вание, чем достигается наибольшая равномерность течения процесса и полнота использования реагирующих ве-ществ. Перемешивание является типичным примером массообмена, ускоряющим процесс естественной диффузии.
4. Большинство химических производственных процессов обратимы. С целью ускорения химической реакции и увеличения выхода продукта в производственных условиях подбирают оптимальные концентрации реагирующих веществ, температуру и давление (для газообразных веществ). Очень часто для изменения направления реакции используют катализаторы (напомним, что использование катализатора не влияет на смещение химического равновесия, так как увеличивает скорость как прямого, так и обратного процессов).
5. Важным технологическим принципом осуществления производственных химических процессов является прин-цип непрерывности производственного процесса, обеспечивающий более высокую производительность труда. Поэтому применение ручных операций, для проведения которых требуется остановка процесса, является неже-лательным явлением. С целью обеспечения непрерывности процесса используют автоматические системы уп-равления (АСУ) и механизацию технологического процесса.
6. С целью наиболее полного использования исходного сырья и ресурсов в химическом производстве применяется также принцип циркуляции вещества. За время прохождения через реакционную установку, то есть за один тех-нологический цикл, исходные вещества не всегда успевают полностью израсходоваться, поэтому непрореагиро-вавшие вещества снова возвращают в аппарат. Например, при синтетическом получении аммиака в контактном аппарате реагирует только 30–37 % смеси азота и водорода; поэтому оставшиеся газы отделяют от образовавшегося жидкого аммиака и с помощью специальных насосов опять направляются в контактный аппарат.
Кроме того, наиболее важный ресурс — вода, также должен использоваться в производственном процессе много-кратно. С одной стороны, вода используется в технологических процессах для охлаждения продуктов реакции и нагревания исходных веществ, то есть выполняет функции теплоносителя, обеспечивая выполнение принципа теплообмена. Такие операции повторяются многократно. С другой стороны, вода используется непосредственно в химических реакциях как растворитель или реагент. Если концентрация загрязняющих веществ в сточных водах не очень высокая, то после очистки реакционная вода также может быть возвращена в технологический цикл.
Циркуляционный принцип использования химических веществ и воды — также один из основных принципов орга-низации современного химического производства.
7. Применение принципа экологической безопасности на химическом производстве обеспечивает защиту окружаю-щей среды. Для реализации этого принципа используется целый комплекс мероприятий, к которым относятся: ис-пользование современного очистного оборудования, организация замкнутых сырьевых и ресурсных циклов про-изводства, использование безопасного сырья и др.
Перечисленные принципы организации современных химических производств основываются на закономерностях химических процессов и обеспечивают экологическую безопасность производства, энерго- и ресурсосбережение.

К важнейшим химико-технологическим и экологическим научным принципам научной организации химических производств относятся:
- увеличение поверхности реагирующих веществ,
- теплообмен (утилизация тепла),
- массообмен (противоток),
- циркуляция реагирующих веществ,
- изменение скорости и направления химических реакций (использование катализатора, оптимальных температур, давления и концентрации),
- исключение ручных операций и автоматизация производства;
- очистка выбросов и сбросов и утилизация отходов производства.
| Принцип | Условия реализации принципа |
| Создание оптимальных условий проведения химических реакций | Противоток веществ, прямоток веществ, увеличение поверхности соприкосновения реагирующих веществ, использование катализатора, повышение давления, повышение концентрации реагирующих веществ |
| Полное и комплексное использование сырья и ресурсов | Циркуляция сырьевых и ресурсных потоков, создание смежных производств (по переработке отходов) |
| Использование теплоты химических реакций | Теплообмен, утилизация теплоты реакции |
| Принцип непрерывности | Механизация и автоматизация производства, исключение из процесса ручных операций |
| Обеспечение экологической безопасности | Автоматизация вредных производств, герметизация аппаратов, утилизация отходов, нейтрализация выбросов в атмосферу и сбросов в водные объекты и канализацию |
ЭКОЛОГИЧЕСКАЯ БЕЗОПАСНОСТЬ ХИМИЧЕСКОГО ПРОИЗВОДСТВА.
ВИДЫ ОТХОДОВ.
Обеспечение экологической безопасности производства является основным фактором производственного процес-са и включает целый комплекс мероприятий по обезвреживанию газовоздушных выбросов, сточных вод и твёрдых отходов.
При этом осадки и шламы, образующиеся в результате процессов очистки сточных вод и газовоздушных выбросов, являются дополнительными источниками образования твёрдых или полужидких промышленных отходов. Количест-венный и качественный состав отходов определяется исходным составом газовоздушных выбросов и сбросов сточ-ных вод и зависит от источника загрязнения и от используемой технологии очистки.
Сточные воды химических производств.
Состав производственных сточных вод зависит от вида используемых производственных процессов и технологий, а также от состава исходного сырья. К основным загрязняющим веществам любого производства можно отнести:
- механические взвеси (окалина, металлическая стружка, пыль, флюсы, минеральные волокна и т.д.);
- минеральные масла и другие нефтепродукты;
- неорганические соединения (кислоты, соли, щёлочи);
- поверхностно-активные вещества (ПАВ);
- различные органические соединения.
Сточные воды химического производства включают специфические химические вещества, характерные для данного производства, некоторые из которых указаны в таблице.
| Виды химического производства | Основные токсичные примеси |
| Нефтеперерабатывающее и нефтехимическое производство | Нафтеновые кислоты, нефтепродукты, фенолы, сульфиды, хлориды, сульфаты, ПАВ, органические взвеси |
| Коксохимическое производство | Фенолы, сероводород, смолы, углеводороды, тиоцианиды, аммиак, цианиды, органические взвеси |
| Производство синтетических полимеров и пластмасс | Стирол, акрилонитрил, акрилаты, сульфаты, фенолы, ароматические углеводороды, альдегиды, спирты, циклогексан, органические кислоты, взвеси |
| Производство синтетического каучука | Бутилен, бутадиен, ацетон, органические кислоты и их соли, ацетонитрил, аммиак, альдегиды, спирты, углеводороды |
| Производство фосфатных удобрений | Серная, фосфорная, кремнефтористоводородная кислоты, соединения фтора, хлороводород |
| Производство хлорна | Ртуть, хлор, хлориды |
| Целлюлозно-бумажное производство | Меркаптаны, сульфиды, ароматические спирты, альдегиды, кетоны, органические взвеси |
Те вещества, которые находятся в стоках в максимальных концентрациях или являются наиболее опасными, считают-ся основными (приоритетными) химическими загрязнителями данного производства. На сегодняшний день известно около млн. химических соединений, из которых почти тысяч используются или образуются в промышленном произ-водстве. Эти вещества могут обладать токсическими свойствами, в этом случае они называются экотоксикантами.
Наиболее опасные и распространенные виды химических загрязнителей:
- ионы тяжелых металлов,
- нефтепродукты;
- стойкие органические загрязнители (СОЗ).
К стойким органическим загрязнителям относятся пестициды и инсектициды различного строения, а также полиаро-матические углеводороды (ПАУ), полихлорированные дибензодиоксины (ПХДД), полихлорированные дифенилы (ПХД), полихлордибензофураны (ПХДФ). Наиболее известный ПАУ — бензапирен, а к классу ПХДД относятся диоксины.
Эти соединения являются суперэкотоксикантами, так как проявляют токсические свойства даже в микроконцентра-циях. Химической особенностью стойких загрязнителей является их способность не разрушаться и сохранять свои токсические свойства в окружающей среде в течение длительного времени.
Методы очистки сточных вод химических производств.
Производственные сточные воды представляют собой многокомпонентные гетерогенные системы, а их очистка — это в первую очередь процесс разделения фаз.
Очистка сточных вод — это технологическая обработка сточных вод с целью разрушения, перевода в нетоксичные формы или извлечения и утилизации (регенерации) загрязняющих веществ.
Очистка сточных вод может рассматриваться как сложное, многостадийное производство, в котором имеется сырьё (сточные воды), готовая продукция (очищенная вода) и отходы производства (осадки). Технологические схемы очистки сточных вод разрабатываются с учетом:
- количественного и качественного состава загрязнений;
- фазового состояния вещества в растворе;
- скорости протекающих процессов;
- некоторых других факторов.
Методы очистки подразделяются на механические, химические, физико-химические, физические и биологические.
Для очистки сточных вод химических производств чаще всего используют химические (реагентные), физико-хими-ческие (коагуляция, ионный обмен, флокуляция) и биологические (аэробное окисление в аэротэнках и биофильтрах) методы. Познакомимся с этими методами.
1. Химические (реагентные) методы очистки стоков.
Очистка сточных вод химическими (реагентными) методами чаще всего используется при наличии в промышленных стоках ионов тяжелых металлов и осуществляется путём их перевода в малорастворимые соединения (гидроксиды или основные карбонаты) за счёт нейтрализации сточных вод с помощью различных щелочных реагентов-осадите-лей (гидроксидов кальция, натрия, магния, оксидов кальция, карбонатов натрия, кальция, магния).
Иногда осаждение ионов невозможно провести в одну стадию (например, в стоках находятся соли хрома() — хроматы или бихроматы. В этом случае на первой стадии производят восстановление таких соединений с помощью реагентов -восстановителей — соединений серы(), железной стружки и др. Реакции проводят в реагентном аппарате (реакторе) путем последовательного добавления реагентов при постоянном перемешивании.
Осаждение образующихся в процессе реагентной обработки нерастворимых соединений осуществляется в отстойни-ках, затем осадок уплотняется и подлежит дальнейшей утилизации (как правило, захоронению на полигоне). Очищен-ная вода может сбрасываться в канализацию или водный объект.
2. Физико-химические методы очистки сточных вод
- Ионный обмен — это обратимая химическая реакция, при которой происходит обмен ионами между твёрдым веществом (ионитом) и раствором электролита. Ионообменники представляют собой сорбционные фильтры, в которых в качестве сорбента используются ионообменные смолы.
Ионообменные смолы — синтетические органические иониты — высокомолекулярные синтетические полимерные соединения (чаще всего полистирол) в виде гранул, которые содержат функциональные группы кислотной или основной природы, способные к реакциям ионного обмена.
Метод ионного обмена используется для глубокой очистки (доочистки) сточных вод от низких концентраций ионов металлов, а также для обессоливания (например, смягчения воды). Поэтому ионообменники нашли широкое приме-нения в быту в качестве бытовых фильтров (типа «Гейзер», «Аквафор» и др.).
В химической промышленности ионнообменные фильтры используются для селективного извлечения ионов тяжёлых металлов. На производстве ионный обмен осуществляют в ионообменных колоннах, при этом слой ионита необходи-мой толщины засыпается на специальную решётку, а очищаемая вода подается снизу вверх, чтобы увеличить время контакта. Смолу нужно периодически регенерировать, то есть очищать от накопленных ионов металлов, что затруд-няет использование данного метода в производстве.
- Коагуляция и флокуляция
Сточные воды некоторых химических производств состоят из загрязнений, имеющих коллоидные свойства (сточные воды нефтехимического производства). Коллоидные и дисперсные частицы не осаждаются и не задерживаются при помощи обычных фильтров в силу малого размера ( нм). С целью более эффективной очистки стоков от таких загряз-нений применяются коагулянты на минеральной основе, представляющие собой гидролизирующиеся соли металлов, например соли алюминия, железа или магния.
Коагуляция— процесс дестабилизации взвешенных коллоидных частиц с последующим выпадением в осадок за счёт электростатических сил межмолекулярного взаимодействия. В процессе коагуляции происходит укрупнение колло-идных частиц в жидкости. В результате образуются агрегаты — более крупные (вторичные) частицы, состоящие из скопления мелких (первичных).
Одним из видов коагуляции является флокуляция, при которой мелкие частицы, находящиеся во взвешенном состоя-нии, под влиянием специально добавляемых веществ (флокулянтов) образуют интенсивно оседающие рыхлые хлопь-евидные скопления.
Коагулянты в воде гидролизуются с образованием гидроксидов металлов, которые оседают и захватывают взвешен-ные частицы загрязняющих веществ (процесс соосаждения).
Коагуляцию проводят в специальных отстойниках, где сточная вода смешивается с раствором коагулянта, а образую-щиеся хлопья выпадают в осадок.
- Флотация
Флотация — процесс выделения из воды в пенный слой взвешенных и коллоидных загрязнений в результате прилипа-ния к пузырькам газа (чаще всего воздуха), подаваемого снизу в очищаемую жидкость.
Процесс очистки производственных сточных вод, содержащих ПАВ, нефть, нефтепродукты, масла, волокнистые мате-риалы, методом флотации заключается в образовании комплексов «частицы-пузырьки», всплывании этих комплексов и удалении образовавшегося пенного слоя с поверхности обрабатываемой жидкости. Прилипание частицы к поверх-ности газового пузырька возможно только тогда, когда наблюдается явление несмачивания или плохое смачивание частицы жидкостью.
Чаще всего флотацию используют для очистки сточных вод, содержащих нерастворимые в воде органические веще-ства, и сочетают с биологическим аэробным окислением, а также при обогащении полезных ископаемых, например рудного сырья.
3. Биологические методы очистки сточных вод
Биологическая очистка сточных вод — биохимический процесс, основанный на способности микроорганизмов использовать растворенные и коллоидные органические загрязнения в качестве источника питания в процессах своей жизнедеятельности.
Биологическая очистка сточных вод может осуществляться как в естественных условиях (поля орошения, поля фильт-рации, биологические пруды), так и в специальных сооружениях (аэротенки, биофильтры). Искусственное культивиро-вание микроорганизмов в специально созданных для них благоприятных внешних условиях (состав питательной сре-ды, избыток растворённого кислорода, температура) резко ускоряет биологическую очистку сточных вод.
В основе биологической очистки сточных вод от органических веществ лежат три взаимосвязанных процесса: синтез протоплазмы клеток микроорганизмов, окисление органических загрязнений и окисление продуктов метаболизма клеток. Для проведения таких процессов требуется участие ферментов. Происходящее при этом аэробное окисление содержащегося в органических веществах углерода до углекислого газа и водорода до воды происходит в присутст-вии кислорода.
Аэротенки — гидросооружения, чаще всего резервуары прямоугольного сечения, в которых процесс изъятия органи-ческих загрязнений осуществляется микроорганизмами-аэробами. В аэротенке происходит смешивание сточной во-ды с активным илом и её биохимическая очистка.
Воздух, вводимый с помощью специальных аэраторов, перемешивает обрабатываемую сточную воду с активным илом и насыщает её кислородом, необходимым для жизнедеятельности бактерий. Большая насыщенность сточной воды активным илом (высокая доза) и непрерывное поступление кислорода обеспечивают интенсивное биохимичес-кое окисление органических веществ, поэтому аэротенки являются одним из наиболее совершенных сооружений для биохимической очистки. В процессе окисления образуются хлопья активного ила. Размер этих хлопьев составляет в большинстве случаев мм.
Биофильтры — сооружения биологической очистки, в которых роль фильтрующего материала выполняет биоплёнка, образующаяся на поверхности загрузочного материала — гранулята.
Биологическая пленка представляет собой особую структуру толщиной до –х мм и является разновидностью активно-го ила. Следует отметить, что видовой состав биопленки гораздо богаче, чем биоценоз активного ила аэротенков и включает множество различных бактерий, простейших и ряд более высокоорганизованных организмов — водорос-лей, грибов и т. д., связанных между собой в единый комплекс сложными взаимоотношениями (метабиоза, симбиоза и антагонизма). Главенствующая роль в этом сообществе принадлежит бактериям. Использование биофильтров повышает эффективность и стабильность очистки сточных вод.
Газовоздушные выбросы химических производств.
Газовоздушные выбросы химических производств могут содержать самые разнообразные химические вещества, па-ры и твёрдые взвешенные частицы (ТВЧ).
Твёрдые частицы и пары образуют с воздухом гетерогенные системы — аэрозоли. Газообразные вещества, например оксиды серы, оксиды азота, углеводороды с короткой цепью и многие другие химические соединения, образуют с воз-духом гомогенные системы. В связи с этим выбросы классифицируют по агрегатному состоянию.
Состав газовоздушных выбросов зависит от применяемых на производстве технологических процессов, сырья и обра-зующихся продуктов. Приоритетные загрязнители некоторых типов производств представлены в таблице.
| Вид производства | Приоритетные загрязняющие вещества |
| Нефтехимическое производство | Оксиды серы, азота, углерода, продукты неполного сгорания и термического разложения топлива, ПАУ (бензапирен), пары бензола, толуола, ацетофенона другие ароматические УВ, сероводород и меркаптаны, предельные и непредельные УВ, ТВЧ (пыли и дымы) |
| Производство фосфатных удобрений | Фтористые газообразные соединения, пыль неорганическая с содержанием (апатитная и фосфоритная пыль), серная кислота пары, фосфорная кислота пары |
| Производство серной кислоты | Серы диоксид, кислота серная, углерода оксид, азота оксид, азота диоксид, сероводород, сера элементарная |
| Производство каучука | Изопентан, толуол, изопрен и анилены, пыль веществ разного химического строения |
| Производство полистирола | Стирол, этилбензол, изопропилбензол, акрилонитрил, пыль полистирола и пары воды |
| Производство искусственных волокон | Сероуглерод, сероводород,изопропиловый спирт, метилакрилат, нитрил акриловой кислоты, аэрозоль серной кислоты, пыль, содержащая роданид натрия, цианиды, красители, продукты синтеза |
| Производство этанола и многоатомных спиртов гидролизное | Фурфорол, формальдегид, пыль, бутанол, содержащая культуры дрожжей, белковых веществ, лигнина, золы |
| Целлюлозно-бумажное производство | Сероводород, метилмеркаптан (ММ), диметилсульфид (ДМС), диметилдисульфид (ДМДС), диоксид серы и пыли различного химического состава |
Для обеспечения экологической безопасности в случае газовоздушных выбросов используют современные методы очистки, которые обеспечивают содержание загрязняющих веществ в пределах экологических норм. Основным нормативом безопасности выбросов и сбросов загрязняющих веществ является предельно-допустимая концентрация (ПДК).
Предельно допустимая концентрация (ПДК) — утверждённый в законодательном порядке санитарно-гигиенический норматив, под которым понимается такая концентрация химических элементов и их соединений в окружающей сре-де, которая при повседневном влиянии в течение длительного времени на организм человека не вызывает патологи-ческих изменений или заболеваний, устанавливаемых современными методами исследований в любые сроки жизни настоящего и последующего поколений.
В зависимости от типа химического производства меняется состав выбросов. Основными выбросами от предприятий химической промышленности являются оксиды углерода, оксиды азота, сернистый ангидрид, аммиак, пыль от неорга-нических производств, органические вещества, сероводород, сероуглерод, хлористые соединения, фтористые соеди-нения и др.
Методы очистки газовоздушных выбросов химических производств.
Очистка и обезвреживание пыли и газовых выбросов — это наиболее распространённый способы защиты атмосферы от загрязняющих веществ. После очистки предусматривается рассеивание в атмосферном воздухе остаточного количества загрязняющих веществ через дымовые трубы.
Процессы очистки осуществляются в установках очистки и обезвреживания газовых выбросов. В зависимости от агрегатного состояния и химических свойств загрязняющих веществ используют разные методы очистки.
Абсорбция и адсорбция
Оба эти физико-химических процесса относятся к видам сорбции — поглощению веществ. Основное различие между ними заключается в механизме взаимодействия сорбента и сорбируемого вещества: абсорбция происходит в объёме сорбента, а адсорбция на поверхности.
Абсорбция — объёмное поглощение газов, паров или твёрдых взвешенных частиц жидкостью (абсорбентом) с образо-ванием раствора.
Для проведения процессов абсорбции, так называемой «мокрой» очистки выбросов, используются аппараты — абсор-беры, или скруберы. Часто процессы абсорбции используются и в быту. Примером абсорбера — аппарата для очистки воздуха от твёрдых взвешенных частиц является пылесос с аквафильтром, а примером абсорбера для очистки воз-душной смеси от смол — кальян. И в том и в другом случае очищаемая воздушная смесь пропускается через слой воды, то есть вода является абсорбентом, при этом в пылесосе частицы пыли прилипают к поверхности пузырьков воздуха (аналогично флотации), а в кальяне — смолистые вещества и частицы дыма поглощаются объёмом воды.
Адсорбция — (лат. ad — на; sorbeo — поглощаю) — увеличение концентрации растворенного вещества у поверхности раздела двух фаз (твёрдая фаза — жидкость, твёрдая фаза — газ и др.).
Поглощение может проводится из газообразной или жидкой среды на поверхности её раздела с жидкостью или твёр-дым веществом (адсорбентом). Хорошими сорбционными свойствами обладают вещества с развитой поверхностью, то есть поверхностью, имеющей большую площадь контакта, например пористые материалы, активированный уголь, торф, силикагель и др. Так, активированный уголь может поглощать пары брома или других газов.
В быту процесс адсорбции используется достаточно широко, например в вытяжках над кухонной плитой. Кроме того, многие сорбенты (активированный уголь, «Смекта», «Энеросгель», «Лактофильтрум» и др.) используются в медицине при острых пищевых отравлениях или аллергических реакциях.
Хемосорбция.
Этот процесс является разновидностью процесса сорбции, но относится к химическим процессам, так как в его основе лежит химическая реакция между абсорбентом (раствором) или адсорбентом (поверхностью твёрдого вещества) и сорбируемым веществом.
Хемосорбция (химическая сорбция) — поглощение жидкостью или поверхностью твёрдого вещества химических веществ из окружающей среды с образованием новых химических соединений.
Иногда бывает трудно отличить адсорбцию и хемосорбцию, однако, в отличие от адсорбции, хемосорбция обычно яв-ляется необратимой. Примером промежуточных вариантов, сочетающих черты и адсорбции и хемосорбции является, например, взаимодействие водорода с поверхностью никелевого катализатора (гетерогенный катализ): при низких температурах водород адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать химическая реакция.
В промышленности процессы объёмной хемосорбции также проводят в аппаратах-абсорберах (скруберах), однако, в отличии от абсорбции, в качестве абсорбента можно использовать не только воду, но и растворы других химических веществ. Преимуществом хемосорбции является возможность получать полезные химические соединения, которые могут использоваться как самостоятельные продукты производства. Например, при очистке газовых выбросов от ам-миака в качестве абсорбента можно использовать раствор азотной кислоты. При этом в результате химической реак-ции образуется нитрат аммония, который является ценным азотным удобрением (аммиачная селитра).
Термические методы очистки газовых выбросов.
Эти методы применяются в газоочистке для удаления или обезвреживания газов и паров, а также твёрдых неоргани-ческих и органических примесей. Метод заключаются в превращении токсичных выбросов при повышенных темпе-ратурах в менее токсичные вещества, которые могут выбрасываться в атмосферу либо улавливаться сорбционными фильтрами.
Термическое разложения примесей происходит при температурах и называется «факельным сжиганием». Чаще всего факельное сжигание применяют на нефтеперерабатывающих заводах (НПЗ) и бурильных установках. Факел над тру-бой видно за много километров.
Каталитические методы газоочистки
Каталитические методы газоочистки также относятся к термическим методам, но они основаны на взаимодействии примесей с другими газообразными компонентами в присутствии катализатора преимущественно при температуре . Каталитическое окисление используется в современных автомобилях для «дожигания» углеводородов в выхлопных газах.
ТЕХНОЛОГИЯ ОСНОВНОГО НЕОРГАНИЧЕСКОГО СИНТЕЗА.
Основной неорганический синтез включает в себя две группы производств: производства соединений связанного азота и производства серы и ее соединений.
ПРОИЗВОДСТВА СОЕДИНЕНИЙ СВЯЗАННОГО АЗОТА.
Основным структурообразующим продуктом производств соединений связанного азота является синтетический аммиак. К промышленности связанного азота относятся также производства азотной кислоты, аммиачной селитры, карбамида, нитритов, нитратов и др. Синтетический аммиак является основным продуктом азотной промышленнос-ти. Это крупнотоннажный продукт. Объем его производства во всем мире составляет более 50 млн т в год.
Производство аммиака в мире особенно интенсивно развивалось в 60–80-е гг. прошлого столетия. Первое производ-ство аммиака возникло в годы Первой мировой войны в Германии. В СССР первое достаточно крупное (30 тыс. т/год) производство аммиака было пущено в 1932 г. в г. Березники.
Первые крупнотоннажные агрегаты по производству аммиака (450 тыс. т продукта в год) в нашей стране были пущены в Невинномысске (1973 г.) и в Новомосковске (1974 г.). В дальнейшем было построено более 25 таких агрегатов в горо-дах Березники, Горловке, Кемерово, Днепродзержинске, Чирчике, Черкассах, Щекино, Гродно, Салавате, Навои, Вах-ше, Ровно, Новгороде, Череповце, Тольятти, Перми, Кирове. После распада СССР в России осталось мощностей по производству аммиака в объеме 14 млн т в год (1996 г.).
Таким образом, современное производство аммиака базируется пока на технологии 70-х гг., в основе которой лежит использование в качестве водородсодержащего сырья природного газа, в качестве основных процессов – каталити-ческих и абсорбционно-десорбционных процессов. Аппараты, в которых протекают эти процессы, объединены в крупнотоннажный энерготехнологический агрегат.

Производство аммиака.
Для нормальной жизнедеятельности растений и животных азот необходим только в усвояемой форме. Но из-за высокой химической инертности азота его неисчерпаемые ресурсы в живой природе практически недоступны. Для решения продовольственной проблемы человечество переводит азот в усвояемую форму, «связывая» его до прос-тейшего соединения — аммиака, из которого затем получают азотную кислоту и минеральные удобрения.
Темпы роста производства аммиака постоянно увеличиваются. При этом количественный рост производства сопро-вождается качественными изменениями структуры производственной базы. Укрупняются мощности единичных агрегатов синтеза аммиака, внедряются новые эффективные катализаторы и сорбенты, разрабатываются прогрес-сивное оборудование и технологические схемы, обеспечивающие более полное использование сырья и топлива. В последние годы за счет лучшей утилизации теплоты производство аммиака удается организовать по энерготехноло-гическому принципу, в котором процесс полностью самообеспечивает себя паром и механической энергией.
В промышленности аммиак получают по методу Габера – прямым взаимодействием азота и водорода в реакционной колонне: N2 + 3Н2 ⇄ 2NH3
Реакция азота с водородом обратимая, экзотермическая, гомогенная (газофазная). Для увеличения выхода аммиака необходимо смещать равновесие в сторону продукта. Согласно принципу Ле-Шателье, для смещения равновесия вправо в данной реакции необходимо повышать давление и понижать температуру. Однако низкая температура уменьшит скорость реакции. Поэтому для повышения скорости реакции температура в процессе поддерживается все-таки высокой, 500-550оС и в присутствии катализатора. А для смещения равновесия применяют очень высокие давления 15-30 МПа.
В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Железные катализаторы получаЮТ при сплавлении Fe3O4 с активаторами (Аl2О3, CaO, MgO, K2O). . Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Производство аммиака состоит из трех стадий: получение азотоводородной смеси, ее очистка и собственно синтез аммиака.
СЫРЬЕ ДЛЯ ПРОИЗВОДСТВА АММИАКА.
Сырьем для производства аммиака являются азот и водород. Азот выделяют из воздуха — газовой смеси, содержащей по объему 78,05% азота, 20,95% кислорода, 0,94% аргона и в незначительных количествах углекислый газ, неон, гелий, криптон и ксенон. Для этого воздух глубоким охлаждением переводят в жидкое состояние, а затем ректификацией, основанной на различии температур кипения отдельных газов, разделяют на составные части.
Водород получают одним из способов: электролизом воды или водных растворов поваренной соли; из коксового газа последовательным сжижением всех его компонентов, кроме водорода; конверсией оксида углерода генераторного газа; конверсией метана или его гомологов.
Получение водорода — наиболее дорогая стадия производства. В настоящее время большую часть водорода для синтеза аммиака получают из наиболее дешевых видов сырья — газов, содержащих метан и его гомологи. К ним относятся попутные газы нефтедобычи, природный газ, газы нефтепереработки. В присутствии водяного пара и кислорода метан превращается в водород. В процессе конверсии метан окисляется по следующей схеме:
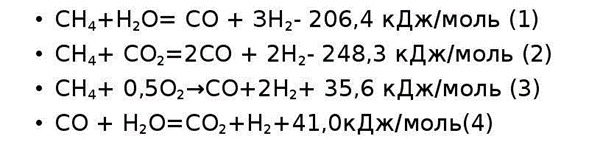
Однако полученные азот, водород и азотоводородная смесь загрязнены попавшими из природного газа соединени-ями серы, а также оксидами и диоксидами углерода, образовавшимися при конверсии. Из-за высокой чувствитель-ности катализатора синтеза аммиака к этим примесям, сильно снижающим его активность и вызывающим необрати-мые отравления (особенно соединения, содержащие серу), газ подвергают тщательной очистке.
СТАДИИ ПРОИЗВОДСТВА АММИАКА.
Основные стадии получения аммиака:
1. смешение свежей азотоводородной смеси (ABC) с циркуляционным газом.
2. очистка полученной газовой смеси от углекислых солей аммония и капелек смазочных масел.
3. синтез аммиака.
4. отделение жидкого аммиака в сепараторе.
5. охлаждение газовой смеси, конденсация аммиака и его сжижение. Константа скорости разложения аммиака на катализаторе может быть найдена по повышению концентрации или давления аммиака за определенное время.
ПРОЦЕССЫ, ПРОТЕКАЮЩИЕ НА РАЗНЫХ УЧАСТКАХ ПРОИЗВОДСТВА АММИАКА.
1 этап. Трубопровод. В трубопровод подается предварительно подготовленная азотно-водородная смесь (N2:Н2=1:3) в соотношении 1 к 3.

2 этап. Турбокомпрессор. Турбокомпрессор используется для сжатия исходной смеси газов с целью повышения давления. Синтез аммиака проводится при очень высоком давлении (15-30 МПа, или 150-300 атм).
3 этап. Колонна синтеза. В колонне синтеза (контактном аппарате) производится синтез аммиака. Азотно-водородная смесь продавливается через полки с катализатором. Процесс синтеза протекает обратимо (т.е. частично) и является сильно экзотермическим, протекает с большим выделением тепла. Часть выделяющегося тепла расходуется на нагре-вание поступающей азотоводородной смеси с помощью теплообменников. Смесь, выходящая из колонны синтеза в холодильник, состоит из аммиака (20-30%) и не прорегировавших азота и водорода. Синтез аммиака идет без обра-зования побочных продуктов по уравнению N2+3H2=2NH3+Q
4 этап. Холодильник. В холодильнике реакционная смесь, которая выходит из колонны синтеза, охлаждается и направляется на дальнейшее разделение в сепаратор.
5 этап. Сепаратор. После прохождения холодильника температура реакционной смеси значительно снижается, и аммиак переходит в жидкую фазу. В сепараторе происходит разделение реакционной смеси, жидкий аммиак отделя-ют от азота и водорода и отправляют на склад.
6 этап. Циркуляционный насос. Циркуляционный насос возвращает не прореагировавшую смесь азота и водорода в контактный аппарат. Благодаря циркуляции удаѐтся довести использование азотно-водородной смеси (конверсию) до 95%.
Свежая азотоводородная смесь в количестве, отвечающем количеству образовавшегося в контактном аппарате амми-ака, добавляется к оборотной смеси.
Производство азотной кислоты.
Промышленность выпускает азотную кислоту двух видов: разбавленную и концентрированную. Разбавленная кислота используется в основном для производства азотсодержащих минеральных удобрений. Концентрированная азотная кислота применяется для производства взрывчатых веществ, красителей, пластических масс, нитролаков, киноплен-ки, и других важных продуктов.
В промышленности кислоту в основном получают аммиачным способом. В России история получения азотной кисло-ты связана с именем химика-технолога Ивана Ивановича Андреева. Он в г. создал первую установку по производству кислоты из аммиака и реализовал разработанный способ в заводском масштабе в г. Первый завод был построен в Донецке.
Производство азотной кислоты аммиачным способом условно отображается следующей схемой:

ЭТАПЫ ПРОИЗВОДСТВА АЗОТНОЙ КИСЛОТЫ.
Процесс получения получения азотной кислоты из аммиака состоит из следующих этапов:
1) Подготовка аммиачно-воздушной смеси: очистка поступающего аммиака от примесей, которые являются ядами для катализаторов.
2) Окисление аммиака кислородом воздуха на платиновой сетке:
3) Дальнейшее окисление оксида азота(II) до оксида азота(IV):
4) Растворение оксида азота(IV) в воде и получение кислоты:
Подготовка аммиачно-воздушной смеси.
Основную массу азотной кислоты производят из синтетического аммиака, получаемого на основе конверсии природ-ного газа. Аммиак, поступающий из цеха синтеза, содержит пыль и пары компрессорного масла, являющиеся катали-тическими ядами на стадии окисления аммиака. Поэтому аммиак подвергается тщательной очистке фильтрованием через матерчатые и керамические (поролитовые) фильтры и промывкой жидким аммиаком. Аналогично очищают от механических и химических примесей воздух, который поступает в цех через заборную трубу, устанавливаемую, как правило, вдали от территории предприятия. Для очистки воздуха используются орошаемые водой скрубберы и матер-чатые двухступенчатые фильтры.
Окисление аммиака.
Очищенный от примесей воздух вместе с аммиаком поступает в контактный аппарат. Там происходит каталитическое окисление аммиака:
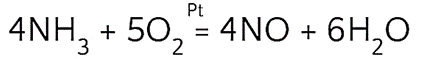
Эта реакция экзотермическая, но необходимая температура поддерживается за счёт выделяемой теплоты.

Одновременно с этой основной реакцией могут протекать и другие реакции.

А также возможны и побочные реакции при синтезе аммиака.

Чтобы не допустить течение этих реакций необходимо контролировать время контакта газовой смеси с катализато-ром. Оно должно быть ничтожно малым. Также следует помнить, что что смеси аммиака с воздухом и с кислородом взрывоопасны, поэтому содержание аммиака в аммиачно-воздушной смеси должно постоянно контролироваться.
Катализатор окисления состоит из сплава платины с родием (или палладием) и представляет собой сетки, сплетённые из тонких ( мм) нитей сплава.
В условиях высоких температур контактирования и высоких скоростей газовых потоков, продуваемых через платино-вые сетки, они механически изнашиваются, что приводит к значительным безвозвратным потерям дорогостоящей платины. Поэтому до сих пор проводятся исследования, направленные на поиск новых, высокоэффективных и менее дорогостоящих катализаторов. Во многих случаях уже используют платиновые катализаторы на основе кобальта, железа, хрома.
Окисление оксида азота(II).
Выходящая из контактного аппарата смесь газов охлаждается в холодильнике; оксид азота(II) окисляется до оксида азота(IV) при обычной температуре:

Обычно окисление ведут под давлением МПа и при соотношении объёмов оксида азота к кислороду , что позволяет существенно сместить равновесие этой реакции вправо. Контакт газов осуществляется в течение нескольких секунд. При этом степень превращения в составляет %.
Поглощение оксида азота(IV) водой.
Газовую смесь, содержащую , направляют в поглотительную башню, которая для увеличения поверхности соприкос-новения газа с водой заполнена фарфоровыми кольцами. Вода в башню поступает сверху, а газовая смесь, содержа-щая оксид азота(), — снизу. Смешивание и взаимодействие веществ происходит по принципу противотока. Процесс ведут в избытке кислорода с целью предотвращения выделения в результате реакции:

Технологической особенностью этой стадии является медленное протекание реакции и снижение скорости раство-рения в воде по мере повышения концентрации получаемой кислоты. Это требует наличия поглотительных уста-новок больших объёмов и указывает на неизбежность выбросов в атмосферу. Однако повышение давления в этой стадии ускоряет процесс окисления и поглощения . Объём поглотительных установок при этом резко снижается, а концентрация возрастает.
Если растворение проводить в присутствии кислорода, то весь оксид азота(II) переходит в азотную кислоту.
Заключительный этап получения азотной кислоты — очистка газов, выходящих в атмосферу, от оксидов азота. Состав этих газов: до 0,2 – 0,25% азота, 3 % кислорода и 2,0% паров воды.оксидов азота. Если оксидов азота в этих отходящих газах больше, то спе-циально проводят каталитическое восстановление их до азота, потому что даже малые коли-чества этих оксидов приводят к большим экологическим проблемам. Основной компонент таких газов – азот. Для восстановления оксидов азота используется аммиак при температуре 120ОС и давлении 0,3 МПа:
6 NO + 4 NH3(избыток) = 5 N2 + 6H2O
6 NO2 + 8 NH3 (избыток) = 7 N2 + 12H2O
Оставшийся аммиак окисляется кислородом воздуха:
4 NH3 + 3О2 = 2 N2 + 6H2O
Очищенный от оксидов азота газ выбрасывается в атмосферу. Поскольку все используемые в схеме очистки хими-ческие процессы проводятся при повышенных температурах, то выбрасываемый после очистки газ является источ-ником энергетического загрязнения атмосферы. Если содержание оксидов азота в выхлопных газах повышено, то применяют многоступенчатые системы очистки, которые также основаны на каталитическом восстановлении оксидов азота до молекулярного азота.
Так как реакция с водой экзотермическая, а при повышенной температуре разлагается, то в обычных условиях полу-чают раствор с концентрацией не менее %. Более концентрированную получают, добавляя концентрированную в качестве водоотнимающего средства.
Научные принципы организации химического производства на примере получения азотной кислоты.
| Общие принципы | Факторы процесса |
| Создание оптимальных условий проведения химических реакций | Противоток веществ Прямоток веществ Увеличение поверхности соприкосновения реагирующих веществ Использование катализатора Повышение давления |
| Полное и комплексное использование сырья и ресурсов | Циркуляция сырьевых и ресурсных потоков |
| Использование теплоты химических реакций | Теплообмен Утилизация теплоты реакции |
| Принцип непрерывности | Механизация и автоматизация производства |
Обеспечение экологической безопасности | Автоматизация вредных производств Герметизация аппаратов Утилизация отходов Нейтрализация выбросов в атмосферу и сбросов в водные объекты и канализацию |
ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ.
Серная кислота – это самый крупнотоннажный продукт химической промышленности. Мировое производство серной кислоты составляет более 150 млн т в год. Значительный рост производства серной кислоты во всем мире произошел в 70–80-х гг. ХХ в. Основное количество серной кислоты расходуют на производство минеральных удобрений и на очистку нефти и нефтепродуктов. Серная кислота также находит применение в металлургии, при получении красите-лей и лекарств, других кислот и солей, как окислитель и водоотнимающее средство в лабораторной практике.

Сырьё.
Сырьевая база производства серной кислоты – серосодержащие соединения (пирит , самородная сера, серосодержа-щие газы — отходы цветной металлургии, воздух.), из которых можно получить диоксид серы. В промышленности около 80% серной кислоты получают из природной серы и железного (серного) колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии. Некоторые производства используют в качестве сырья сероводород, образующийся при очистке серы в нефтепереработке. Первый обжиг серосодержащего сырья для получения диоксида серы.
Стадии производства.
Производство серной кислоты включает в себя следующую последовательность стадий:
1. Обжиг серного колчедана.
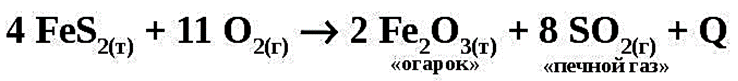
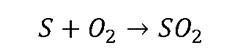
Сырьём для производства серной кислоты служат самородная сера и сульфидные руды. Среди них наибольшее значение имеет железный колчедан (пирит) . В природе он залегает массивными плотными слоями, из которых добывается в виде кусков, которые дробят и измельчают.
При производстве серной кислоты из пирита сернистый газ получают путём обжига серного колчедана. Эта реакция является экзотермической, необратимой, некаталитической, гетерогенной. Производительность печи растёт с увеличением скорости реакции обжига. Этого добиваются, применяя для данной реакции оптимальные условия.
- Измельчение пирита. Пирит перед обжигом измельчают до оптимальных размеров, увеличивая площадь его соприкосновения с кислородом воздуха. Частицы не должны быть крупными, иначе они будут обжигаться только на поверхности, а внутри останется непрореагировавший пирит, что приведёт к потерям сырья. Слишком мелкое измельчение тоже нежелательно, так так оно приводит к слёживанию, уплотнению слоя, что уменьшает скорость реакции вследствие сокращения площади соприкосновения пирита с кислородом.
- Обогащение воздуха кислородом позволяет увеличить концентрацию одного из реагирующих веществ, что способствует увеличению скорости реакции.
- Обжиг пирита в кипящем слое. Чтобы увеличить скорость обжига, используют принцип противотока: сверху в печь подают измельченный пирит, а снизу — воздух, обогащённый кислородом. Воздух вдувается через множество трубок под определённым давлением, которое отрегулировано так, чтобы частицы пирита не распылялись и не слёживались. Частицы оказываются в подвешенном состоянии, создавая иллюзию кипящей жидкости. Поэтому такой слой мелких частиц называется «кипящим». Обжиг в «кипящем слое» повышает площадь соприкосновения пирита и кислорода, что приводит к увеличению скорости реакции.
- Поддержание определённой температуры. Оптимальной считается температура 850 – 900°С. Поскольку реак-ция является экзотермической и идёт с выделением тепла, то температура в процессе обжига будет повышаться, что может привести к спеканию частиц пирита. Чтобы избежать этого, избыток теплоты отводят. В реакционный аппарат встраивают трубки, по которым пускают холодную воду. Нагреваясь, вода забирает лишнее тепло и превращается в водяной пар, который используется для производства электроэнергии или для других целей.
- Процесс обжига пирита непрерывный и механизированный. Пирит подаётся ленточным транспортёром в бункер и из него в печь. Огарок, образующийся в процессе обжига, частично уносится печным газом, частично выво-дится через боковое отверстие в печи.
Печной газ, полученный при обжиге пирита, содержит примеси: огарок , примеси , соединения , водяные пары. Сна-ча ла газ необходимо очистить от пыли. Это осуществляется при помощи двух аппаратов: циклона и электрофильтра. От крупной пыли газ очищают в циклоне. Он состоит из двух цилиндров, вставленных один в другой. Газ подается сбоку в наружный цилиндр и перемещается сверху вниз по спирали. Под действием центробежной силы частицы пыли отбрасываются к стенкам наружного цилиндра и падают в бункер, откуда затем удаляются. Очищенный газ по внутреннему цилиндру уходит из аппарата и попадает в электрофильтр, в котором очищается от мелкой пыли.
Электрофильтр состоит из мелких сеток, между которыми протянута проволока. К ней подведён ток высокого напря-жения (). При этом проволока заряжается отрицательно, а сетки положительно. Газ поступает в камеру снизу. Под дей-ствием сильного электрического поля частицы пыли ионизируются и притягиваются к сеткам. Там они теряют свой заряд и падают вниз в специальный бункер.
От водяных паров газ освобождают в сушильной башне. Сернистый газ поступает в башню снизу, а сверху разбрызги-вается концентрированная серная кислота (принцип противотока). Сушильная башня заполнена керамическими кольцами. Кислота, стекая по кольцам вниз, образует на их поверхности плёнку. При этом площадь соприкосновения кислоты и газа многократно увеличивается.
Очищенный газ подогревают в теплообменнике, используя тепло стадии процесса. Газовую смесь перед началом реакции окисления сернистого газа нужно нагреть, так как в процессе очистки она охлаждается. Поэтому перед контактным аппаратом помещают теплообменник. Горячий газ из контактного аппарата пропускают по трубам теплообменника, а между ними в противоположном направлении пропускают подогреваемую смесь газов. Таким образом происходит теплообмен между продуктами реакции и исходными веществами, поступающими в контакт-ный аппарат.
2. Окисление диоксида серы.

Эта реакция является обратимой и экзотермической и протекает с уменьшением объема. Она осуществляется на катализаторах, основой которых является V2O5 с добавлением оксидов щелочных металлов, нанесенных на оксид кремния.
Согласно принципу Ле-Шателье, повышение температуры смещает равновесие реакции окисления сернистого газа в серный ангидрид влево, то есть, вызывает разложение серного ангидрида. Поэтому процесс желательно проводить при низких температурах. В то же время, если не прибегать к нагреванию, то скорость реакции, то есть скорость дос-тижения состояния равновесия, оказывается необычайно низкой. Оптимальной температурой, при которой окисле-ние происходит с заметной скоростью, является температура.
Процесс проводят в контактном аппарате, представляющем собой цилиндр. В нём на специальных полках слоями размещен катализатор. Между полками с катализатором находится трубки теплообменника. При этом одновременно решается проблема нагревания сернистого газа и охлаждения до необходимой температуры образующегося оксида серы(VI) (принцип теплообмена).
3. Абсорбция триоксида серы.

Эта реакция является экзотермической, необратимой при меньше , некаталитической.
Поглощение оксида серы(VI) происходит в поглотительной башне, заполненной керамическими кольцами. Газ пода-ется снизу, а сверху разбрызгивается 98,3%-ная серная кислота. Поглощать серный ангидрид водой нельзя, так как над ней всегда находится пар, который образует с серным ангидридом очень устойчивый сернокислотный туман. Процесс осуществляют в специальных поглотительных башнях, по устройству напоминающих сушильные. При этом используют принцип противотока — пары оксида серы(VI) подаются снизу, а навстречу ему сверху течёт серная кисло-та.
Продуктом взаимодействия концентрированной серной кислоты с оксидом серы(VI) является олеум. В отличие от кон-центрированной серной кислоты, олеум сильно дымит — из него выделяется оксид серы(VI) — SO3. При растворении олеума в воде образуется серная кислота. Олеум хранят и перевозят в стальных цистернах — при комнатной темпера-туре сталь устойчива к действию концентрированной серной кислоты и серного ангидрида.


0 Комментариев