ХИМИЧЕСКАЯ СВЯЗЬ. СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ.
Разные вещества имеют различное строение. Среди них только благородные газы — гелий Не, неон Ne, аргон Аr, криптон Кr, ксенон Хе и радон Rn — существуют в виде свободных (изолированных) атомов. Это обусловлено высокой устойчивостью их электронных структур. Все другие вещества состоят из связанных атомов. Силы, которые обусловливают связь между атомами, получили название «химическая связь». По своей природе эти силы являются электростатическими. Они представляют собой различные виды взаимодействия электрических зарядов (электронов и ядер взаимодействующих атомов). Результатом связывания атомов является образование более сложных структур — молекул, молекулярных ионов, свободных радикалов, а также ионных, атомных и металлических кристал-лических решеток.
Оглавление
Ковалентная связь является причиной образования большинства молекул, молекулярных ионов, свободных радикалов и атомных кристаллических решеток.
Ионная связь обусловливает существование молекул ионных соединений и ионных кристаллических решеток.
Металлическая связь существует в простых веществах-металлах.
Водородная связь существует внутри молекул отдельных веществ, а также возникает между молекулами некоторых веществ.
ИОННАЯ СВЯЗЬ.
При описании строения атомов было отмечено, что все атомы, за исключением атомов благородных газов, стремятся присоединить или отдать электроны. Причина — образование устойчивого восьмиэлектронного внешнего уровня (как у благородных газов). При приёме или отдаче электронов возникают электрические заряды и, как следствие, электростатическое взаимодействие частиц. Так возникает ионная связь. Ионная связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (∆ЭО > 1,7), общая электронная пара полностью переходит к атому с большей ЭО. Наименьшую ЭО имеют типичные металлы, атомы которых наиболее легко отдают электроны, а наибольшую ЭО имеют типичные неметаллы, атомы которых легко присоединяют электроны. Поэтому ионная связь образуется между атомами типичных металлов и атомами типичных неметаллов. При отдаче электронов атомы металлов превращаются в положительно заряженные ионы, которые называются катионами: Na° — 1ē -> Na+ — катион натрия; При присоединении электронов атомы неметаллов превращаются в отрицательно заряженные ионы, которые называются анионами:
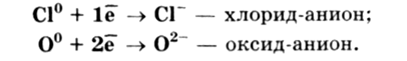
Схема образования ионной связи при взаимодействии атомов натрия и хлора:

Ионы имеют завершенные электронные конфигурации, т. е. при образовании ионной связи атомы переходят в более устойчивое состо-яние.
Ионная связь не имеет направленности и насыщаемости.
Ионные соединения часто имеют сходные свойства. Они стремятся образовывать группы, которые, в свою очередь, образуют еще более крупные группировки, типа LinClm. Такие образования называются кристаллами. Это происходит из-за того, что ионная связь не имеет направленности и насыщаемости.
Так как в ионном соединении притяжение катионов и анионов очень сильное, то для их разделе-ния потребуется большое количество энергии. Поэтому часто они имеют высокие температуры кипения и плавления, намного большие, чем другие соединения.
Имеют ионную кристаллическую решетку. В узлах решетки находятся ионы.
Ионные соединения чрезвычайно твердые, т.к. в кристалле трудно отделить ионы друг от друга, но при этом они очень хрупкие.
Расплавленные или растворенные в воде они проводят электрический ток, являются электролитами.
КОВАЛЕНТНАЯ СВЯЗЬ.
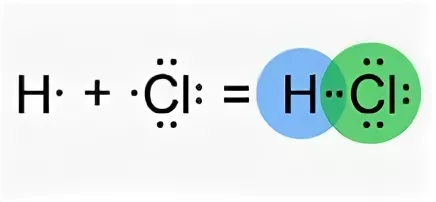
При образовании химической связи между атомами главную роль играют их валентные электроны.В 1916 г. Г. Н. Льюис (США) высказал мысль о том, что химическая связь возникает в результате образования общих электронных пар между взаимодействующими атомами. Рассмотрим образование простейшей молекулы — молекулы водорода Н2. Схема образования общей электронной пары:
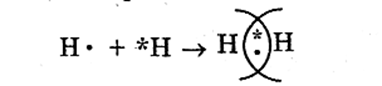
Электронная формула атома водорода— Н∙ . При сближении двух атомов водорода их неспаренные электроны объединяются и обра-зуют общую электронную пару, т. е. пару, которая принадлежит обоим атомам.
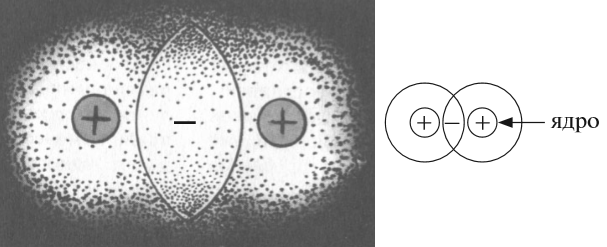
Поскольку вокруг ядер атомов расположены отрицательно заряженные электроны, между атомами возникают силы отталкивания. Но если атомы обладают достаточной энергией, их электронные облака перекрываются. В этой области пространства возникает избыточный отрицательный заряд. Ядра атомов имеют положительный заряд, поэтому ядра обо-их атомов притягиваются к общему отрицательному заряду, который возник благодаря перекрыванию электронных облаков.

Следовательно: во-первых, область перекрывания электронных облаков является химической связью; во-вторых, чем больше область перекрывания электронных облаков, тем прочнее данная связь. Таким образом, в образующейся молекуле каждый атом водорода имеет два электрона, т.е. приобретает устойчивую электронную структуру. Общую электронную пару в графических формулах молекул показывают в виде черточки: Н—Н. Любая молекула является устойчивой только в том случае, если при ее образовании из атомов происходит уменьшение полной энергии системы. Поэтому образование химической связи — это процесс, который сопровождается выделением энергии.
•Если между двумя атомами образуется только одна общая электронная пара, то такая ковалентная связь называется одинарной (простой) связью.
•Ковалентные связи, при образовании которых область перекрывания электронных облаков находится на линии, соединяющей ядра атомов, называются σ-связями (сигма-связями).

Одинарные связи всегда являются σ-связями.
•π-связи — это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов. s-облака не могут образовывать π-связи. В образовании π-связей могут участвовать р- и d-облака. π-связи образуются в тех случаях, когда между двумя атомами возникают две или три общие электронные пары. Число общих электронных пар между связанными атомами характеризует кратность связи.
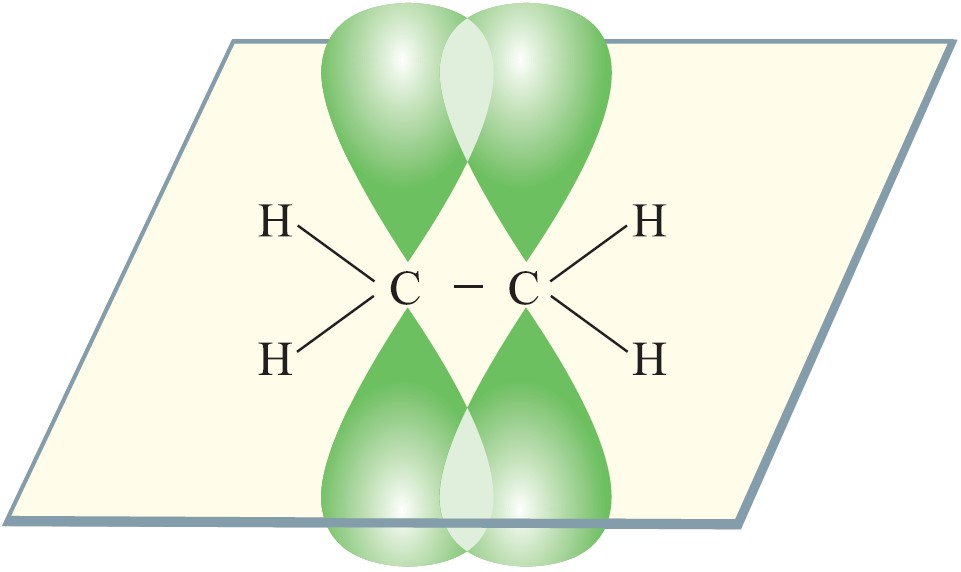
Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойной связью: А = В. Любая двойная связь состоит из одной σ-связи и одной π-связи.

Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройной связью: А ≡ В. Любая тройная связь состоит из одной σ-связи и двух π-связей.
Двойные и тройные связи имеют общее название кратные связи.
Важной характеристикой ковалентной связи является полярность связи.
Полярность связи зависит от электроотрицательности элементов, атомы которых участвуют в образовании связи.
Электроотрицательность (ЭО) элемента характеризует способность его атома в молекуле притягивать к себе общую электронную пару.
НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ.
Если ковалентная связь образуется между атомами с одинаковой ЭО, то общая электронная пара (область перекрывания электронных облаков) находится на одинаковом расстоянии от ядер обоих атомов. Такая связь называется неполярной связью. Неполярные связи существуют в молекулах простых веществ: Н2, N2, Сl2, 02 и т. д.

Молекулы с неполярными связями являются неполярными молекулами.
Если ковалентная связь образуется между атомами с различной ЭО, — то общая электронная пара (область перекрывания электронных облаков) смещается в сторону атома с большей ЭО.
В результате смещения электронной плотности на атоме с большей ЭО возникает избыточный отрицательный заряд (—δ), а на атоме с меньшей ЭО — положительный заряд (+δ).
ПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ.
• Ковалентная связь с неравномерным распределением электронной плотности между взаимодействующими атомами называется полярной связью.
Если молекула состоит из двух атомов, которые связаны полярной связью, то такая молекула является полярной молекулой, т. е. пред-ставляет собой диполь.
• Диполь — это электронейтральная система, в которой центры положительного и отрицательного зарядов находятся на определенном расстоянии друг от друга.
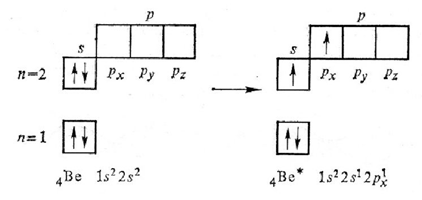
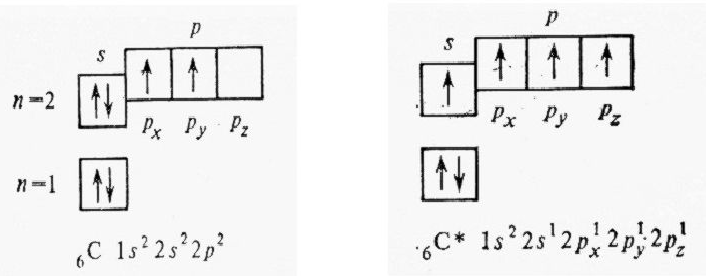
В образовании ковалентных связей участвуют неспаренные электроны, поэтому валентность элемента определяется числом неспарен-ных электронов в его атоме. Число неспаренных электронов в атомах многих элементов при образовании химических связей может увеличиваться в результате перехода атомов из основного состояния в возбужденное состояние.
Возбужденное состояние атома — это состояние с более высокой энергией, чем основное. Процесс перехода атома из основного в воз-бужденное состояние называется возбуждением атома.
Возбуждение атома при образовании химических связей обычно представляет собой разъединение спаренных электронов и переход одного из них с данного подуровня на свободную орбиталь другого подуровня. Этот переход происходит в пределах одного энергетичес-кого уровня.

Переход атома в возбужденное состояние обусловливает увеличение валентности элемента и является причиной существования переменной валентности.
Причиной постоянной валентности элементов во всех соединениях является отсутствие возможности атома перейти в возбужденное состояние, потому что на внешнем энергетическом уровне нет свободных орбиталей.
В возбужденных атомах неспаренные электроны находятся на разных подуровнях, и орбитали этих электронов различаются по энергии и по форме. Однако ковалентные связи, которые образуют эти электроны, являются равноценными. Это объясняется явлением гибриди-зации орбиталей.
В отличие от ионных соединений, молекулы ковалентных соединений удерживаются вместе за счет «межмолекулярных сил», которые намного слабее химических связей. В связи с этим, ковалентной связи характерна насыщаемость – образование ограниченного числа связей.
Атомные орбитали ориентированы в пространстве определенным образом, поэтому при образовании связи, перекрывание электрон-ных облаков происходит в определенном направлении. Следовательно для ковалентной связи характерно такое свойство, как направленность.
Для ковалентной связи характерна полярность, которая возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрица-тельностью.
Электрическое поле частиц, образуемых ковалентную связь способно смещать электроны и характеризуется понятием поляризуемос-ти связи. При удалении электрона от ядра, т.е. с увеличением длины связи ослабевает его притяжение к ядру и он становится более подвижен. Чем больше длина связи, тем более поляризуема связь.
Соединения с ковалентной связью:
- Летучи
- имеют низкие температуры плавления и кипения.
- электрический ток не может проходить через эти соединения, следовательно, они плохие проводники и хорошие изоляторы.
- при подводе тепла, многие соединения с ковалентной связью, загораются. В большей части это углеводороды, а также оксиды, сульфиды, галогениды неметаллов и переходных металлов.
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ.
Гибридизация атомных орбиталей — это смешение атомных орбиталей (электронных облаков) различного типа (например, s- и р-орбиталей), в результате которого образуются одинаковые по форме и энергии гибридные орбитали. Число образующихся гибридных орбиталей равно числу орбиталей, которые участвуют в гибридизации. Наиболее важные типы гибридизации орбиталей: sp (смешение одной s- и одной р-орбитали), sp2 (смешение одной s- и двух р-орбиталей), sp3 (смешение одной s- и трех р-орбиталей).
sp-Гибридизация
Рассмотрим этот тип гибридизации на примере молекулы хлорида бериллия ВеСl2. Валентность бериллия в этом соединении равна II, т.к. число неспаренных электронов в возбужденном состоянии атома бериллия равно 2: 2
В результате гибридизации одной 2s-орбитали и одной 2р-орбитали образуются две гибридные орбитали, которые располагаются на одной линии (угол между орбиталями 180°). sp-гибридные орбитали атома бериллия перекрываются с р-орбиталями атомов хлора с образованием двух σ-связей. Гибридные sp-облака всегда располагаются под углом 180°, поэтому для молекул, которые содержат sp-гибридизованные атомы, характерно линейное строение.
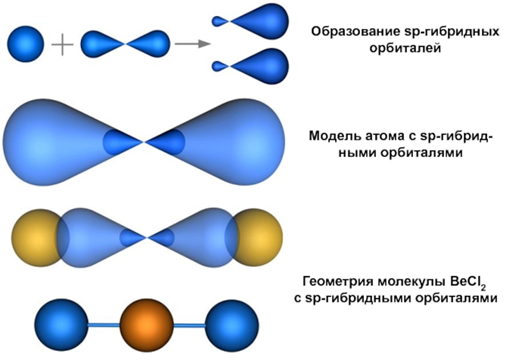
Каждая связь Be—Сl является полярной связью, так как ЭО(Сl) > ЭО(Ве). Векторы дипольных моментов двух связей Be—Сl в молекуле ВеСl2 равны по величине, но имеют противоположное направление, поэтому векторная сумма равна нулю. Значит, что молекула ВеСl2 является неполярной молекулой.
Полярность молекулы зависит не только от полярности имеющихся в ней химических связей, но и от геометрической формы молекулы.
sp2-Гибридизация
Этот тип гибридизации рассмотрим на примере молекулы хлорида бора ВСl3. Валентность бора в этом соединении равна III, что соот-ветствует числу неспаренных электронов в возбужденном состоянии атома:
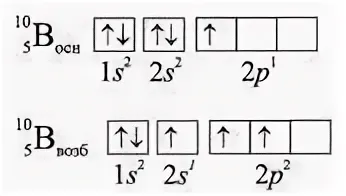
в результате гибридизации одной 2s-орбитали и двух 2p-орбиталей образуются три гибридные орбитали, которые располагаются в одной плоскости; угол между орбиталями 120°. Гибридные sр2-орбитали атома бора перекрываются с р-орбиталями трех атомов хлора с обра-зованием трех σ-связей. Молекула ВСl3 имеет форму равностороннего треугольника.
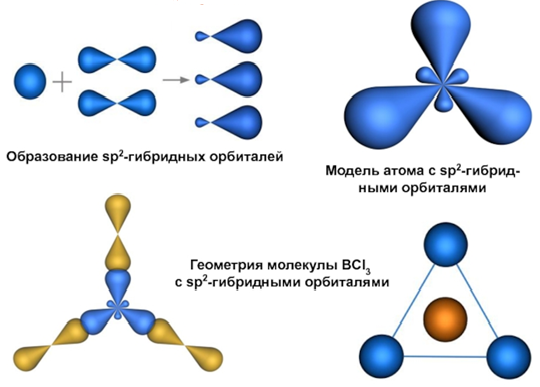
Эта молекула является примером неполярных молекул, содержащих полярные связи.
sp3-Гибридизация
В состоянии sp3— гибридизации находится атом углерода в молекуле метана СН4. В этом соединении атом углерода образует 4 одинарные связи, т. е. его валентность равна IV. Такую валентность углерод имеет в возбужденном состоянии: 2
В результате гибридизации одной 2s-орбитали и трех 2р-орбиталей образуются четыре гибридные орбитали, которые располагаются под углом 109,5° друг к другу и направлены к вершинам тетраэдра, в центре которого находится ядро атома углерода. При перекрывании гибридных sр3-орбиталей с s-opбиталями четырех атомов водорода образуются четыре σ-связи. Молекула СН4 имеет форму тетраэдра. Дипольный момент этой молекулы (т. е. векторная сумма дипольных моментов связей С—Н) равен нулю, следовательно, молекула является неполярной.

В образовании ковалентных связей принимают участие «обычные» облака (s, р, d, f) и гибридные облака (sp, sp2, sp3 и др.). Все эти облака имеют определенную ориентацию в пространстве. Поэтому ковалентные связи, которые образуют эти облака, характеризуются направленностью.
Направленность ковалентных связей обусловливает определенное пространственное строение молекул ковалентных соединений.
Обменный механизм — механизм образования ковалентной связи, при котором каждый атом предоставляет для создания общей электронной пары один неспаренный электрон.
ДОНОРНО-АКЦЕПТОРНАЯ СВЯЗЬ.
Существует ещё один механизм образования ковалентной связи, который называется донорно-акцепторным механизмом. Ковалентная связь, которая образуется по донорно-акцепторному механизму, называется донорно-акцепторной связью. При образовании донорно-акцепторной связи один атом (донор) предоставляет неподеленную пару электронов, которая становится общей электронной парой меж-ду ним и другим атомом (акцептором).
Донорно-акцепторная связь образуется в результате перекрывания орбитали с неподеленной электронной парой атома-донора и свободной орбитали атома-акцептора. Образование донорно-акцепторной связи можно рассмотреть на примере иона аммония NH4+. Этот сложный ион образуется в результате присоединения иона водорода Н+ к молекуле аммиака NH3:
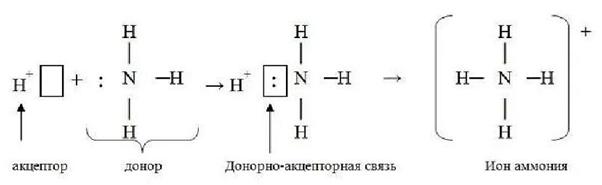
Три неспаренных электрона, которые находятся на 2р-подуровне, участвуют в образовании трех ковалентных связей с атомами водорода в молекуле NН3.


Это обычные связи, образованные по обменному механизму. Неподеленная электронная пара, которая находится у атома азота на 2s-подуровне, может участвовать в образовании донорно-акцепторной связи, т. е. атом азота в молекуле аммиака может быть донором электронной пары. Ион водорода вообще не имеет электронов, но имеет свободную ls-орбиталь, поэтому он может быть акцептором электронов. Донорно-акцепторная связь имеет такие же свойства, как и обычная ковалентная связь, а отличается от нее только проис-хождением общей электронной пары. Все четыре связи N—Н в ионе аммония являются равноценными. Это обусловлено тем, что в мо-мент образования связи в атоме азота происходит гибридизация 2s-орбитали и трех 2р-орбиталей, т. е. sр3-гибридизация. В результате возникают четыре одинаковые гибридные орбитали, которые направлены к вершинам тетраэдра. Таким образом, ион аммония, как и молекулы типа АВ4, имеет тетраэдрическую форму.
Валентность азота в ионе аммония равна IV, так как он образует четыре ковалентные связи. Если элемент образует ковалентные связи и по обменному, и по донорно-акцепторному механизму, то его валентность больше числа неспаренных электронов и определяется общим числом орбиталей на внешнем электронном слое. К ним относятся: а) орбитали с неспаренными электронами; б) орбитали с неподеленными электронными парами; в) свободные орбитали.
Для азота валентность IV является максимальной, потому что внешний электронный слой атома азота (второй энергетический уровень) состоит из четырех орбиталей.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ.
Атомы металлов отдают электроны, которые находятся на внешнем электронном слое. В результате атомы металлов превращаются в положительно заряженные ионы. Это происходит не только при взаимодействии металлов с другими веществами, но и при образовании простых -веществ-металлов. Простые вещества, которые образуют элементы-металлы, при обычных условиях представляют собой твердые кристаллические вещества. В кристаллах металлов часть их атомов находится в ионизированном состоянии. В узлах кристаллической решетки металлов находятся положительные ионы и атомы металлов, а между узлами — электроны. Эти электроны становятся общими для всех атомов и ионов металла и могут достаточно свободно перемещаться по всей кристаллической решетке.

Электроны, которые находятся в кристаллической решетке металлов, называются свободными электронами, или «электронным газом».
• Связь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов называется металлической связью. Металлическая связь обусловливает важнейшие физические свойства металлов.
ВОДОРОДНАЯ СВЯЗЬ.
Является особым видом химической связи. В образовании этой связи участвует атом водорода, который в данной молекуле уже связан обычной ковалентной связью с атомом какого-либо элемента, имеющего большую электроотрицательность (с фтором, кислородом, азо-том). Ковалентные связи Н—F, Н—О, Н—N являются сильно полярными (большая разность ЭО). Поэтому атом водорода имеет избыточ-ный положительный заряд- +δ, а на атомах фтора, кислорода и азота находятся избыточные отрицательные заряды.

Врезультате электростатического взаимодействия происходит притяжение положительно заряженного атома водорода одной молекулы к электроотрицательному атому другой молекулы. Определенный вклад в образование водородной связи вносит донорно-акцепторное взаимо-действие «полусвободной» ls-орбитали атома водорода и орбитали с неподеленной парой электронов электроотрицательного атома:
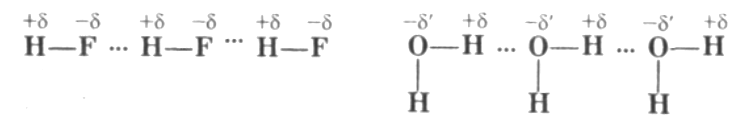
Водородные связи обозначаются точками. Образование межмолекулярных водородных связей является причиной существования ассо-циатов молекул типа (HF), (H20) и др. Водородная связь может быть межмолекулярной и внутримолекулярной. Например, в салициловом альдегиде происходит образование водородной связи между атомом водорода группы —ОН и атомом кислорода группы >С=0:
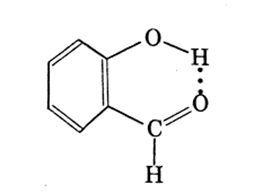
При образовании водородной связи атом водорода находится между двумя атомами с высокой ЭО; с одним из них он связан обычной ковалентной связью, а с другим — водородной связью. Энергия водородной связи приблизительно в десять раз меньше энергии обычной ковалентной связи.
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ.
Между молекулами в веществе всегда присутствует некоторое притяжение друг к другу, которое называется межмо-лекулярным взаимодействием. Притяжение молекул друг к другу не такое сильное, как взаимодействие между атомами в молекуле, и недостаточно для образования химических связей, но достаточно для того, чтобы сделать их слегка «клейкими» друг к другу. Эти взаимодействия (силы) называются ван-дер-ваальсовыми взаимодействиями (силами). Они получили такое название в честь голландского физика Йоханнеса Дидерика Ван-дер-Ваальса, который открыл их. Они обусловливают притяжение молекул данного вещества (или различных веществ) друг к другу в газообразном, жидком и твердом агрегатном состояниях.
Одним из видов ван-дер-ваальсовых сил является ориентационное взаимодействие. Такое взаимодействие возникает между дипольны-ми молекулами; противоположно заряженные концы диполей притягиваются друг к другу.
Если рядом находятся полярная и неполярная молекулы, то под влиянием полярной молекулы в неполярной молекуле возникает ди-поль. Постоянный диполь и индуцированный диполь притягиваются друг к другу. Такой вид взаимодействия называется индукционным. В неполярных молекулах за счет флуктуации (отклонение, смещение) электронной плотности возникают мгновенные диполи, между которыми также действуют силы притяжения. Эти силы называются дисперсионным взаимодействием.
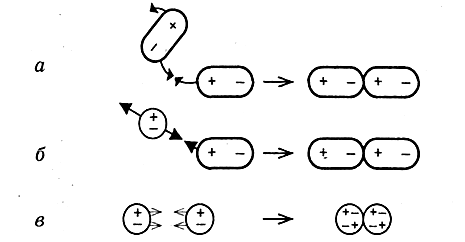
ХИМИЧЕСКАЯ СВЯЗЬ И АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВ. КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ.
Тип химической связи влияет на свойства вещества и на его поведение в растворах. Чем больше притяжение между частицами, тем труднее их оторвать друг от друга, тем труднее перевести твёрдое вещество в газообразное или жидкое состояния. Рассмотрим схемы веществ, образованных различными типами молекул, и определим, между какими частицами больше силы взаимодействия:
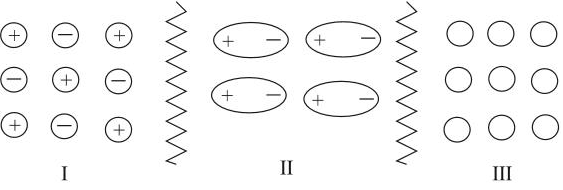
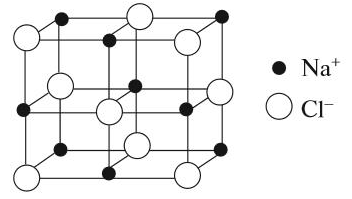
Если силы притяжения частиц значительны (притяжение разноимённо заряженных ионов), то частицы колеблются вблизи положения равновесия, а перемещаться не могут, что обусловливает сохранение формы и объёма. Максимальное взаимодействие между части-цами осуществляется в случае I (ионная связь). Такие вещества находятся в твёрдом состоянии. Все вещества, построенные по ионно-му типу, — твёрдые. Среди веществ с ионной структурой ни жидких, не газообразных веществ нет! Для таких веществ характерно особое внутреннее строение — кристаллическая решётка:
Наименьшее взаимодействие между незаряженными частицами, случай III, поэтому между молекулами вещества с неполярной кова-лентной связью силы притяжения ничтожны. В этом случае молекулы свободно двигаются во всех направлениях, вещество находится в газообразном состоянии. Вещества, состоящие из неполярных молекул или молекул с неполярными связями, являются газами или летучими жидкостями. Среди веществ такого типа только йод является твёрдым (при нормальных условиях) из-за высокой массы молекул, но он легко возгоняется, переходя из твёрдого состояния сразу в газообразное состояние. У полярных молекул (диполей) межмолекулярные взаимодействия многократно сильнее, поэтому частицы могут перемещаться «на один шаг», соблюдая ближний порядок, что обусловливает текучесть жидкости. Молекулы с полярными связями могут быть и газообразными, и твёрдыми.
От типа кристаллической решётки, которая формируется в твёрдом состоянии, зависят многие физические свойства вещества. В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решёток: ионные, атомные, молекулярные и металлические.
Кристаллические решётки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служить кристалл поваренной соли (хлорида натрия), в котором каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия. Такие вещества обладают твёрдостью, тугоплавкостью, их расплавы проводят электрический ток. Ионные соединения легко растворяются в жидкостях, состоящих из полярных молекул, например в воде, хотя бывают и исключения.
Большинство веществ, построенных при помощи ковалентной связи, состоят из отдельных молекул.
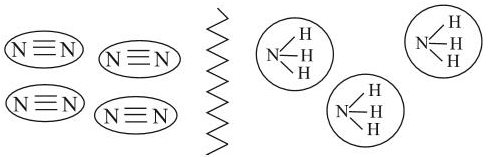
К таким веществам относятся спирты, сахара и большинство органических соединений. Поэтому, если такое вещество станет твёрдым, то эти молекулы образуют молекулярную кристаллическую решётку, т. е. в узлах её находятся молекулы. Кристаллические решётки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решётках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решёткой имеют малую твёрдость и низкие температуры плавления, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решёткой невелико: вода, кислоты.

Кристаллические решётки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решётках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами:

Весь кристалл алмаза следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твёрдого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием, а также кварца — чистого оксида кремния. Такие вещества очень прочные и тугоплавкие. Они нерастворимы в воде и прочих растворителях.
Металлы образуют металлическую кристаллическую решётку.
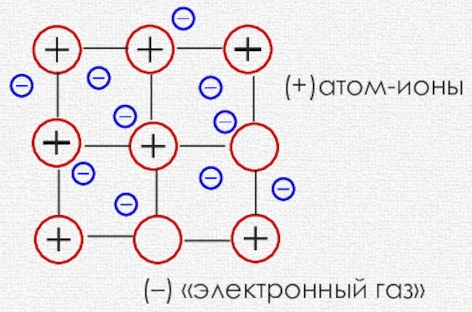
Для веществ с металлической кристаллической решеткой характерны механическая прочность, плавкость, ковкость, хорошая тепло — и электропроводность, металлический блеск.

- молекулярное строение имеют вещества, построенные при помощи ковалентной связи, которые, связывая атомы, образуют молекулы;
- немолекулярное строение имеют вещества, построенные при помощи
- ковалентной связи, которые связывают отдельные атомы;
- металлической связи;
- ионной связи.

СТЕПЕНЬ ОКИСЛЕНИЯ ЭЛЕМЕНТОВ.
Степень окисления является важной характеристикой состояния атома в молекуле. Степень окисления элемента в данном соединении — это реальный или условный заряд, который имеет атом этого элемента в этом соединении.
В соединениях с ионной связью степени окисления элементов равны реальным зарядам ионов.
- NaCl Степень окисления натрия = +1 Степень окисления хлора = — 1
- CaF2 Степень окисления кальция = +2 Степень окисления фтора = -1
В соединениях с ковалентной неполярной связью (в молекулах простых веществ) степени окисления элементов равны нулю: Н2°, Cl2°. Степень окисления элементов равна нулю во всех простых веществах: S0, С0, Р°, Na°, Al°, Fe° и др.
В соединениях с ковалентной полярной связью степень окисления элемента — это условный заряд его атома в молекуле, если считать, что молекула состоит из ионов, т. е. рассматривать ковалентные полярные связи как ионные связи. При этом считают, что общие электронные пары полностью переходят к атомам элементов с большей ЭО.
Например, в молекуле хлороводорода НСl ковалентная полярная связь Н : Сl. Если общая электронная пара полностью перейдет к атому хлора (ЭОСl > ЭОн), то связь станет ионной. На атоме Н появится заряд +1, на атоме хлора будет заряд — 1. Следовательно, степени окисления атомов в молекуле равны: НСl.
Любая молекула является электронейтральной, поэтому алгебраическая сумма степеней окисления всех атомов в молекуле всегда равна нулю.
Некоторые элементы во всех сложных веществах имеют постоянную степень окисления:

Водород и кислород в большинстве сложных веществ имеют постоянные степени окисления, но есть исключения:

Все другие элементы в различных соединениях имеют разные степени окисления, т. е. являются элементами с переменной степенью окисления.
При определении степени окисления необходимо знать, что:
- Атомы металлов во всех сложных веществах имеют только положительные степени окисления.
- Атомы неметаллов могут иметь и положительные, и отрицательные степени окисления. В соединениях с металлами и водородом степени окисления неметаллов всегда отрицательные.
- Высшая (максимальная) степень окисления элемента, как правило, равна номеру группы, в которой находится элемент в периодической системе.
- Низшая (минимальная) степень окисления металлов равна нулю. Низшая степень окисления неметаллов обычно равна: — (8 — номер группы, в которой находится элемент).
- Значения степеней окисления элемента между высшей и низшей степенями окисления называются промежуточными.
Задания для самопроверки.
- Что называется химической связью?
- Какие типы химической связи вы знаете?
- Какие электронные структуры внешнего слоя стремятся приобрести атомы при образовании химической связи?
- Что происходит с электронными облаками при образовании ковалентной связи?
- В каком случае ковалентная связь называется одинарной (простой) связью?
- Какие связи называются σ-связями? Что такое π-связи?
- Что характеризует кратность связи?
- Какие связи называются кратными?
- Что характеризует электроотрицательность элемента?
- Какая связь называется: а) неполярной связью; б) полярной связью?
- Что такое диполь?
- Является ли молекула воды диполем?
- Чем определяется валентность элемента в ковалентных соединениях?
- Что такое возбужденное состояние атома?
- Что является причиной переменной валентности многих элементов?
- Что такое гибридизация атомных орбиталей?
- Какие типы гибридизации являются наиболее важными?
- Какое геометрическое строение характерно для молекул, которые содержат sp-гиб-ридизованные атомы?
- Чему равны степени окисления элементов в соединениях с ионной связью?
- Какие степени окисления имеют водород и кислород в большинстве сложных веществ? Какие вы знаете исключения
- Какие степени окисления (положительные или отрицательные) имеют атомы металлов и неметаллов в сложных веществах?
- Что называется ионной связью? Между атомами каких элементов она образуется?
- Что называется металлической связью?
- С атомами каких элементов атом водорода обычно образует водородные связи?
- Как называются силы, которые обусловливают притяжение между молекулами любого вещества в газообразном, жидком и твердом агрегатных состояниях?
- Для атомов элементов 2-го и 3-го периодов напишите электронные и электронно-графические формулы внешнего электронного слоя в возможных возбужденных состояниях.
- Какой тип гибридизации характерен для: а) кремния в SiCl4; б) магния в MgBr2; в) алюминия в АlВr3? Нарисуйте схемы перекрывания электронных облаков в данных молекулах. Какова геометрическая форма этих молекул? Являются ли они полярными или неполярными?
- Какие из следующих молекул являются полярными и какие неполярными: 0F2, MgBr2, PCl8, ВСl3, H2S, AlBr3? Почему?
- Молекула оксида углерода (IV) С02 имеет линейную форму. Сколько σ- и π-связей в этой молекуле? Какие электронные облака атома углерода участвуют в образовании этих связей? Является ли молекула СО2 полярной пни неполярной?
- 29.Напишите электронные формулы атомов следующих элементов: 3Li, 38Sr, 35Br, 31Ga. Какие элементарные ионы могут образовать атомы этих элементов? Напишите уравнения процессов образования этих ионов.
- Допишите уравнения следующих процессов образования ионов: а) Са° — 2ē = …; б) S°… = S2ˉ в) Fe° — Зē = …; г) Fe°… = Fe2+.
- Определите заряды ионов в следующих соединениях: ALF,CsCl, Rb2О, СаВr2.
- Какой атом является донором и какой — акцептором электронов при взаимодействии молекул NH3 и BF3 с образованием молекулярного соединения BF3 • NH3? Чему равны валентности бора и азота в образующемся соединении?
- Определите степени окисления и валентности: а) фосфора в РН3, Р2О3 Н3РО4, Мg3Р2; б) брома в: NaBr, HBrO, КВrО3, Вr2О5; в) хрома в: Сr2О3, К2СrО4, Н2Сr2О7, Сr(ОН)3;
Для закрепления изученного материала перейдите по ссылке: https://learningapps.org/watch?v=pq1u5h5uj22 и выполните задания.
Выполните итоговый тест по темам «Периодическая система. Химическая связь.», перейдя по ссылке: https://onlinetestpad.com/46hmxyhzabk2s


0 Комментариев