ГЕТЕРОЦИКЛЫ.
Гетероциклические соединения представляют многочисленный класс органических соединений. Некоторые из них играют важную роль в природе, так как являются биологически активными соединениями. Наиболее распространены в природе пяти- и шестичлен-ные кислород-, азот- и серосодержащие гетероароматические соединения.
Гетероциклическими соединениями (гетероциклами) называют вещества, молекулы которых содержат замкнутый цикл, включаю-щий атомы углерода и один или более атомов иных элементов (гетероатомов). Простейшие кислород- и серосодержащие гетероциклы

этиленоксид фуран пиран тиофен
Классификация гетероциклических соединений.
- по числу гетероатомов в цикле: трех-, четырех-, пяти- и шестичленные циклы,
- по природе гетероатомов (чаще всего атомы O, S, N): кислородсодержащие, серосодержащие, азотсодержащие гетероциклы и пр.,
- по числу, взаимному расположению и размеру циклов: 1. по наличию конденсированных систем, состоящих из одного или нескольких колец бензола и гетероцикла; 2. по наличию конденсированных систем, состоящих из двух или более гетероциклов.
АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛЫ.
К азотистым гетероциклам относятся N-содержащие гетероциклы:


Индол является представителем конденсированных гетероциклов, имеющих в своем составе бензольное кольцо и пятичленный гетероцикл, а пурин представляет собой конденсированную систему, состоящую из двух гетероцик-лов: шестичленного цикла пиримидина + пятичленного цикла имидазола.
Номенклатура гетероциклических соединений.
Номенклатура гетероциклических соединений является достаточно сложной в связи с многообразием представителей этого класса. В химии гетероциклических соединений применяются тривиальные названия; при наименовании пяти- и шестичленных соединений, содержащих один или два гетероатома N, O или S в подавляющем большинстве случаев используются тривиальные названия (пир-рол, фуран, тиофен, пиридин и т.д.). В систематической номенклатуре моноциклических соединений гетероатом всегда получает первый номер.
В номенклатуре конденсированных гетероциклов используются принципы общей номенклатуры конденсированных циклических систем. Конденсированная гетероциклическая система разбивается на два или более составляющих гетероциклов и карбоциклов, каждая из частей получает отдельное название, после чего эти названия объединяются в название конденсированного гетероцикла с указанием мест их сочленения. Основной цикл определяется в соответствии с Правилами определения основного гетероцикла и обозначается в виде корня названия, а побочный — в виде приставки. Обычно нумерация начинается с атома, соседнего с местом сочленения циклов, но так, чтобы гетероатом получил наименьший номер. Атомам углерода, принадлежащим одновременно двум циклам (сочлененным), присваиваются номера с индексом a, b, c и т.д.. Например, в молекуле индола основ-ным циклом является пиррол, побочным — бензол, поэтому в названии приставка «бензо», а корень — «пирол». Нумерация начинается с атома азота и осу-ществляется против часовой стрелки, месту сочленения присваивается индекс b.

Свойства азотсодержащих гетероциклов.
В молекулах азотсодержащих гетероциклов атом азота связан с атомами углерода, как в аминах. Поэтому в таких соединениях эти группы проявляют свойства, характерные для аминов.
Многие нитропроизводные углеводородов являются взрывчатыми веществами (нитроглицерин, тринитротолуол и др.). Отличитель-ной особенностью азотсодержащих гетероциклов является то, что многие из них, даже при отсутствии нитрогрупп, являются взрыв-чатыми веществами. Взрывчатые свойства большинства используемых мощных взрывчатых веществ связывают с наличием в сос-таве их молекул нитро (−NO2) или нитратных групп (−O−NO2). Такие группы (точнее, группы N=O) Вант−Гофф называл «эксплозофор-ными атомными комплексами». Изменение реакционной способности азотсодержащих циклических соединений, по сравнению с углеродными аналогами, связывают с дезактивацией цикла при последовательном введении атомов азота.

Электрофильность гетероароматических соединений растёт при уменьшении π-электронной плотности, то есть при увеличении числа гетероатомов и, при их равном числе, электрофильность выше для шестичленных, чем для пятичленных гетероциклов.
Строение и свойства пятичленных азотсодержащих гетероциклов.
Пиррол – С4Н4NH – пятичленный гетероцикл с одним атомом азота.
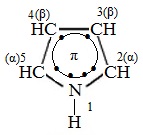
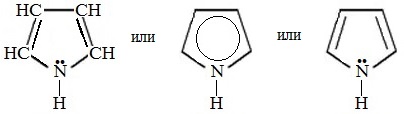
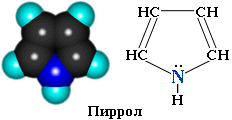
Электронное строение молекулы пиррола
Электронное строение молекулы пиррола объясняет его свойства как слабой кислоты, так и ароматического соединения.
Электронная пара атома азота в пирроле входит в состав ароматической системы, поэтому пиррол практически лишен основных свойств.

Атомы углерода и азота находятся в состоянии sp2-гибридизации. σ-Связи C–C, C–H и C–N образованы гибридными орбиталями. Цикл имеет плоское строение. На негибридной р-орбитали азота находится неподеленная пара электронов, которая вступает в сопряжение с четырьмя р-электронами атомов углерода, находящихся на негибридных орбиталях.
Таким образом, в циклической системе сопряжения находится 6 электронов, что определяет ароматические свойства пиррола.
Физические свойства.
Пиррол – бесцветная жидкость с запахом хлороформа, Ткип= 1300С, практические не растворим в воде, растворяется в спирте и ацетоне, на воздухе быстро окисляется и темнеет. Сосновая лучина, смоченная соляной кислотой, окрашивается парами пиррола в красный цвет (отсюда название pyrrol – «красное масло»).
Химические свойства
Кислотные свойства
Связывание неподеленной электронной пары атома азота системой сопряжения приводит к резкому ослаблению основных и прояв-лению кислотных свойств.
1. Взаимодействие с активными металлами
Как слабая кислота пиррол вступает в реакцию с металлическим калием, образуя соль — пиррол-калий (пироллат калия):

Ароматические свойства
1. Реакции присоединения
Гидрирование. Гидрирование пиррола приводит к образованию пирролидина.
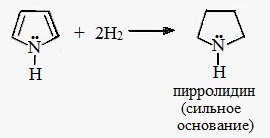
При гидрировании пиррола образуется пирролидин – циклический вторичный амин, проявляющий значительные основные свойст-ва.
Полимеризация. Под действием сильных минеральных кислот пиррол вступает в реакции полимеризации. Сильные минеральные кислоты могут вытягивать электронную пару атома азота из ароматической системы, при этом ароматичность нарушается, и пиррол превращается в неустойчивое соединение, которое сразу полимеризуется. Неустойчивость пиррола в кислой среде называют «ацидо-фобностью».
2. Реакции электрофильного замещения
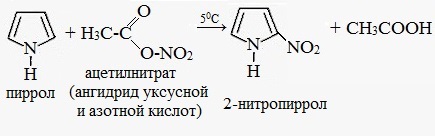
Нитрование. Пиррол как ароматическое соединение склонен к реакциям электрофильного замещения, которые протекают у α-атома углерода (соседнего с атомом азота). Поскольку пиррол под действием кислот полимеризуется, то для проведения замещения испо-льзуют реагенты, не содержащие протонов.
Для нитрования пиррола используют ацетилнитрат:
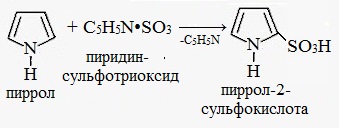
Сульфирование. Для сульфирования пиррола используют комплекс пиридина с оксидом серы (VI):
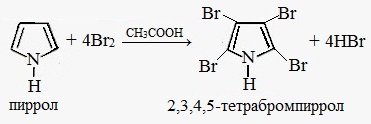
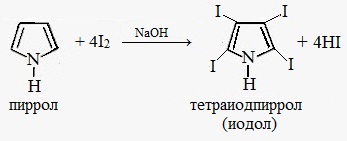
Галогенирование. Пиррол значительно активнее бензола в реакциях электрофильного замещения, т.к. атом азота, предоставляя в систему сопряжения два электрона (+М-эффект), повышает электронную плотность в цикле.
Пиррол может вступать в реакции замещения, в ходе которых замещаются атомы водорода при атомах углерода:
Способы получения
1. Получение из фурана и тиофена
Аммонолиз пятичленных циклов с другими гетероатомами — тиофена и фурана (реакция Юрьева).

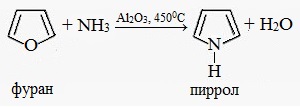
2. Получение из ацетилена
Пиррол получают конденсацией ацетилена с аммиаком.
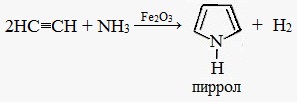
Биологическая роль
Производные пиррола являются биологически важными природными соединениями. Пиррольные структуры содержатся в гемоглобине, хлорофилле, витамине В12 и некоторых других природных соединениях. В состав молекул этих сложных веществ входит тетрапиррольный фрагмент (порфин)

в виде комплекса с металлом:
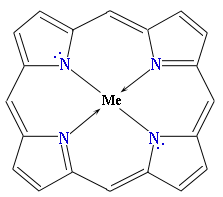
где Ме — металл
(Fe в гемоглобине, Mg в хлорофилле, Co в витамине В12) — порфирины. Замещенные порфины называют порфиринами.
Строение и свойства шестичленных азотсодержащих циклов.
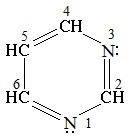
Пиримидин С4Н4N2 — шестичленный гетероцикл с двумя атомами азота. Его можно рассматривать как аналог бензола, в котором две группы СН заменены на атомы азота.
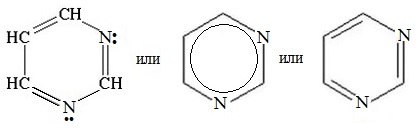
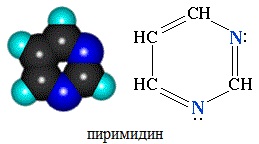
Пиримидин проявляет свойства очень слабого основания, т.к. атомы азота в sp2-гибридизованном состоянии довольно прочно удер-живают неподеленную электронную пару.
Для пиримидина, подобно пиридину, характерна 6p-электронная ароматическая система. Поэтому его цикл обладает повышенной устойчивостью.
Благодаря наличию в кольце двух электроотрицательных атомов азота, пиримидин еще менее активен в реакциях электрофильно-го замещения, чем пиридин. Его основные свойства также выражены слабее, чем у пиридина.
Пиримидин — низкоплавкое кристаллическое вещество, хорошо растворимое в воде, Тпл= 22,50C, Ткип= 1240C.
Основное значение пиримидина состоит в том, что он является родоначальником класса пиримидиновых оснований.
Остатки трех пиримидиновых оснований (урацила, тимина, цитозина) входят в состав нуклеиновых кислот.
Пиридин- шестичленный азотсодержащий гетероцикл, представляет собой ароматическую 6π-электронную систему,

которая образуется за счет π-электронов трех двойных связей кольца. Неподеленная пара электронов атома азота лежит в плоскости, пер-пендикулярной плоскости π-системы кольца и не принимает участия в создании ароматического секстета.

Поэтому для пиридина характерны следующие особенности химических свойств:
- во-первых, атом азота обладает основными и нуклеофильными свойствами,
- во-вторых, за счет большей, чем у углерода, электроотрицательности атома азота ядро пиридина приобретает π- дефицитность, так как электронная плотность в кольце распределена неравномерно и частично локали-зована на атоме азота.
Таким образом, химические свойства пиридина определяются наличием ароматической системы, с одной стороны, и атома азота с неподеленной электронной парой — с другой.
1. Основные свойства. Пиридин — более слабое основание, чем алифатические амины, но его водный раствор окрашивает лакмус в синий цвет:
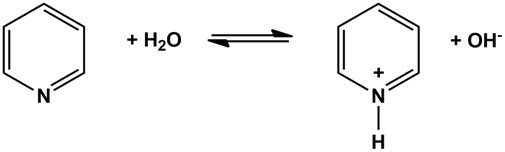
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:

Нуклеофильность кольцевого атома азота проявляется также в его способности к алкилированию и ацилированию. При алкилирова-нии образуются устойчивые пиридиниевые соли (аналогично солям аммония).

2. Ароматические свойства пиридина. Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота. Атом азота в реакциях электро-фильного замещения ведет себя как заместитель II рода, поэтому электрофильное замещение происходит в мета-положение. Например, пиридин нитруется при 300∘C с низким выходом:

3. Нуклеофильное замещение. В отличии от бензола, пиридин способен вступать в реакции нуклеофильного замещения в бензоль-ное кольцо. Поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, то орто-пара-положения (по отношению к атому азота) имеют пониженную электронную плотность. Поэтому пиридин может реагировать с амидом натрия, образуя смесь орто- и пара-аминопиридинов (реакция Чичибабина):

4. Гидрирование пиридина. При гидрировании пиридина образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:

5. Окисление боковой цепи. Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты:

Никотиновая кислота и ее амид — важные лекарственные препараты. Кроме того, пиридин применяется при изготовлении других лекарственных препаратов, при денатурации спирта, при производстве красителей, инсектицидов, а также как катализатор органи-ческого синтеза и растворитель.

Гомолог пиридина — 3-метилпиридин (в-пиколин) — при окислении образует никотиновую кислоту:
Никотиновая кислота и ее амид — никотинамид представляют собой две формы витамина РР, который

применяется для лечения пеллагры (кожное заболевание).
Строение конденсированных гетероциклов.
Индол (бензо[b]пиррол, 2,3-бензпиррол) конденсированное гетероциклическое соединение, состоящее из бензольного ядра и гетероцикла пиррола. Представляет собой бесцветные кристаллы с запахом, напоминающим нафталин или капусту. Индольное ядро входит во множество биохимических природных соединений. Как индивидуальное вещество содержится в каменноугольной смоле и в некоторых эфирных маслах, например, в масле жасмина. Некоторые производные индола очень широко использовались в качестве красителей до конца 19-го века. В 1930-х годах интерес к индолу вновь увеличился, когда стало известно, что индольное ядро входит в молекулы многих важных алкалоидов, в аминокислоту триптофан и другие биохимически важные вещества. До сих пор он продолжает интенсивно изучаться.
Физические свойства.
При нормальных условиях представляет собой бесцветные листовидные кристаллы с резким запахом, напоминающим запах прелой капустной кочерыжки. Легко краснеет при воздействии солнечного света и воздуха. В сильно разбавленном виде запах цветочный и напоминает цветки жасмина.
Растворимость в некоторых растворителях: в бензоле — растворим; в воде — плохо растворим; в диэтиловом эфире — легко растворим; в метаноле — растворим.
Химические свойства.
Индол по своей реакционной способности схож с бензолом, но более реакционноспособен. Неподеленная пара электронов азота в индоле является частью ароматического секстета, поэтому индол не проявляет склонности к связыванию протона и лишен основных свойств. Напротив, в реакциях с сильными основаниями индол проявляет свойства слабой NH-кислоты.
Как слабая кислота, индол в растворе натрия в жидком аммиаке (NH3) образует N-натрийиндол, с гидроксидом калия (КОН) при 130 °C — N-калийиндол.
Обладает ароматическими свойствами. Электрофильное замещение идёт в положении 3 атома углерода. Замещение в бензольном кольце (в положения 4 и 6) идёт лишь в кислых средах. В присутствии воды или на свету индол окисляется в индоксил, который затем превращается в индиго.
2.Пурин — молекула пурина представляет собой систему из пиримидинового и имидазольного циклов, имеющих два общих угле-родных атома.Производные пурина называются пуриновыми основаниями. Остатки двух пуриновых оснований (аденина и гуа-нина) входят в состав нуклеиновых кислот.
ГАМК (C4H9O2N) -гамма-аминомасляную кислоту или 4-аминобутановую кислоту открыли в 1950 году. Впервые она стала прода-ваться в 60-е годы прошлого столетия в Японии в качестве лекарственного средства под названием гаммалон. Предполагалось, что данный препарат способен улучшать мозговые метаболические процессы, оказывать седативный эффект, способствовать восста-новлению функций мозга после нарушений мозгового кровообращения и травм. В СССР препарат появился в 70-е годы под назва-нием аминалон. Изначально аминалон широко применялся при умственной отсталости в геронтологической практике, однако впоследствии оказалось, что данный препарат не обладает высокой эффективностью (предположительно из-за плохого проникно-вения через гематоэнцефалический барьер).
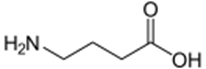
Ноотропное средство, восстанавливает процессы метаболизма в головном мозге, способствует утилизации глюкозы мозгом и удалению из него токсичных продуктов обмена. Повышает продуктивность мышления, улучшает память, благоприятно влияет на восстановление движений и речи после нарушения мозгового кровообращения, оказывает лёгкое психостимулирующее действие. Обла-дает лёгким гипотензивным действием, снижает исходно повышенное артериальное давление и выраженность обусловлен-ных гипертонией симптомов, незначительно урежает частоту сердечных сокращений. Оказывает умеренное антигипоксическое и проти-восудорожное действие. У больных сахарным диабетом снижает содержание глюкозы, при нормальном содержании глюкозы в кро-ви оказывает обратный эффект.
Применение
Применяется при сосудистой патологии головного мозга с целью повышения психической и двигательной активности, алкоголь-ных энцефалопатиях и полиневритах, умственной отсталости. Показанием также являются энцефалопатические и церебрастени-ческие проявления из-за стойких и динамических нарушений мозгового кровообращения (гипертоническая болезнь, посттравма-тический период, атеросклероз, инсульт. Применяется при умственной отсталости и снижении психической активности у детей.
Гамма-аминомасляная кислота в организме позвоночных образуется в центральной нервной системе из L-глутаминовой кислоты.
В нервной системе γ-аминомасляная кислота выполняет функцию ингибирующего медиатора центральной нервной системы. При выбросе ГАМК в синаптическую щель происходит активация ионных каналов ГАМКА и ГАМКС — рецепторов, приводящая к ингиби-рованию нервного импульса. Лиганды рецепторов рассматри-ваются как потенциальные средства для лечения различных рас-стройств психики и центральной нервной системы, к которым относятся болезни Паркинсона и Альцгеймера, расстройства сна, эпилепсия. Установлено, что ГАМК является основным нейромедиатором, участвующим в процессах центрального торможения. Под влиянием ГАМК активируются энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение. В экстремальных условиях при большом недостатке энергии ГАМК окисляется в мозге бескислородным путём, при этом выделяется много энергии и нормализуется содержание гистамина и серо-тонина в мозге.
ГАМК обнаружена в бета-клетках поджелудочной железы в концентрациях, сопоставимых с таковыми в ЦНС. Секреция ГАМК в бета-клетках происходит совместно с секрецией инсулина. ГАМК опосредованно ингибирует секрецию глюкагона, связанную с повышением концентрации глюкозы в крови.
ГАМК в виде пищевых добавок применяется при умственной отсталости, после инсульта и травм мозга, для лечения энцефалопа-тии и ДЦП.
Считалось, что экзогенная ГАМК не проникает через гематоэнцефалический барьер, однако сейчас есть свидетельства того, что ГАМК транспортируется в мозг с помощью специфических мембранных транспортеров и экзогенная ГАМК в форме пищевых добавок может оказывать ГАМКергические эффекты и на кишечную нервную систему, которая, в свою очередь, стимулирует выработку эндогенной ГАМК.
Парааминобензойная кислота (ПАБК) — 4-Аминобензойная кислота или пара-аминобензойная кислота — циклическая аминокисло-та, производное бензойной кислоты, широко распространена в природе. В твёрдой фазе — бесцветные кристаллы. Природная, синтезируемая дрожжами, некоторыми бактериями и растениями, или синтетическая, — используется для синтеза лекарственных соединений (например, новокаина, анестезина и др.), для защиты от повреждающего действия ультрафиолета, в зарубежной медицине — в качестве пищевых добавок, будучи включенной в группу витаминов группы В, в диагностических тестах при исследовании состояния желудочно-кишечного тракта.

Остаток а-аминобензойной кислоты участвует в синтезе пуринов и пиримидинов и, следовательно, РНК и ДНК. 4-Аминобензойная кислота является «фактором роста» для многих видов бактерий, например, лакто и бифидобактерий, кишечной палочки. Участвует в синтезе витамина В9, и в образовании эритроцитоа т.е. эритропоэзе. Также усиливает выделение молока у кормящей женщины, способствует установлению загара.
Структурными аналогами 4-аминобензойной кислоты являются сульфаниламиды, способные подавлять рост микроорганизмов. ПАБК является сырьём для производства азокрасителей и производных. Также ПАБК используется в качестве активного вещества в неко-торых лекарственных препаратах (Актипол-М).
Парааминобензойная кислота или витамин В10, Н1, ПАБК, РАВА – витаминоподобное соединение, производное бензойной кислоты, оказывающее мощное антиоксидантное действие на организм человека. Наименование вещества произошло от двух слов – «пан» – всюду, «гами» – семя, что указывает на широкое распространение нутриента в природе, например, в семенах растений. Соединение стимулирует рост лакто – и бифидобактерий, обладает противовирусными свойствами, применяется для изготовления новокаина. Бактериальный витамин Н1 защищает кожу от пагубного воздействия солнечных лучей, улучшает состояние волос, поэтому произ-водители добавляют средство в состав бальзамов-ополаскивателей, кремов для тела, шампуней, мазей против ожогов, лосьонов для загара, кондиционеров. 4-аминобензойная кислота представляет собой порошок белого цвета, имеет кристаллическую структуру, хорошо растворяется в спирте, эфире, плохо – в воде. ПАБК стойка к воздействию высоких температур, не разрушается при кипении (температура плавления достигает 187 градусов), чувствительна к свету. Структурная формула соединения – C7H7NO2. Н1 препятст-вует преждевременному старению, появлению морщин. Участвует в обмене белков (ДНК и РНК), синтезировании пиримидинов, пу-ринов, выработке меланина. Способствует росту мышечной ткани. Участвует в обеспечении нормального пищеварения. Укрепляет иммунитет, стимулирует синтез интерферона, повышая устойчивость организма к возбудителям инфекций. Защищает печень от цирроза. Необходим для замены структур клеток, тканей, поддержания здоровья мужчин (препятствует появлению болезни Пейрони). Нормализует жировой обмен, содержание холестерина в крови, предотвращая появление атеросклероза. Препятствует развитию похмелья. Улучшает кроветворение (снабжает кровь кислородом, участвует в производстве эритроцитов), снижает риск развития анемии, образования тромбов, инсультов. Защищает кожу от УФ-лучей, повышает ее тонус и упругость, устраняет гиперпигментацию, обеспечивает формирование ровного загара. Препятствует выпадению волос, поддерживает их естественную окраску, предохраняет от раннего поседения. Улучшает восстановление тканей после травм, рост у детей, подростков, выработку женского молока при лактации. Стимулирует размножение полезной микрофлоры в кишечнике. Помимо этого, парааминобензойная кислота повышает эффективность витаминов группы В (В5, В9) и С.
Анестезин, этил-4-аминобензоат, С9Н11NO2, этиловый эфир парааминобензойной кислоты, этиловый эфир 4-аминобензойной кислоты

Белый кристаллический порошок без запаха, слабо горького вкуса. Вызывает на языке чувство онемения. Очень мало растворим в воде, легко в спирте, эфире, хлороформе, трудно растворим в жирных маслах и разведенной соляной кислоте.Температура плавления от 89 до 92 °С.
Исходным веществом для синтеза анестезина служит п-нитротолуол.
- окисление п-нитротолуола до п-нитробензойной кислоты хромовой смесью:

- этерификация п-нитробензойной кислоты этиловым спиртом С2Н5ОН в присутствии конц. серной кислоты:
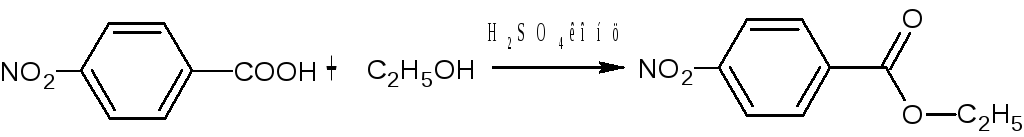
- восстановление нитрогруппы до аминогруппы железом в присутствии уксусной кислоты:

Прокаин — новокаин, гидрохлорид диэтиламиноэтилового эфира пара-аминобензойной кислоты — анестетик с умеренной актив-ностью. Новокаин был получен в 1904 году. Являясь слабым основанием блокирует Na+-каналы и препятствует генерации импульсов в оконч-аниях чувствительных нервов и проведению импульсов по нервным волокнам. Подавляет проведение не только болевых, но и импульсов другой модальности. При всасывании и непосредственном сосудистом введении в ток крови снижает возбудимость пе-риферических холинергических систем, устраняет спазм гладкой мускулатуры, уменьшает возбудимость миокарда и моторных зон коры головного мозга. При внутривенном введении оказывает анальгезирующее, противошоковое, гипотензивное и антиаритми-ческое действие, в больших дозах может нарушать нервно-мышечную проводимость.

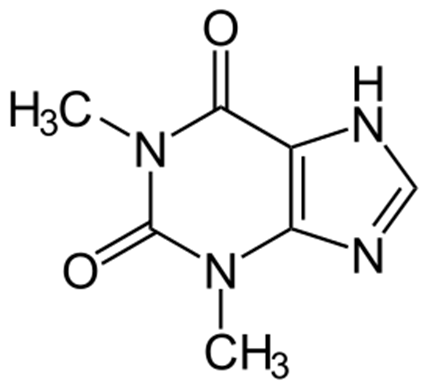
Теофилли́н (от лат. Thea — чайный куст и греч. phyllon — лист), также известный как 1,3-диметилксантин с молекулярной формулой C7H8N4O2 — психоактивное вещество, метилксантин, лекарство, использую-щееся при терапии респираторных заболеваний, таких как хроническая обструктивная болезнь лёгких и астма, выпускается под различными торговыми наименованиями. Небольшое количество теофиллина произ-водится в печени, как продукт метаболизма в ней кофеина. Теофиллин нормализуя дыхательную функцию, способствует насыщению крови кисло-родом и снижению концентрации углекислоты; усили-вает вентиляцию лёгких в условиях гипокалиемии, оказывает стимулирующее влияние на деятель-ность сердца, увеличивает силу сердечных сокращений и ЧСС, повышает коронарный кровоток и пот-ребность миокарда в кислороде, снижает тонус кровеносных сосудов (главным образом сосудов мозга, кожи и почек), уменьшает лёгочное сосудистое сопротивление, понижает давление в малом круге кровообраще-ния, увеличивает почечный кровоток, ока-зывает умеренный диуретический эффект, расширяет внепечё-ночные желчные пути, тормозит агрегацию тромбоцитов, повыша-ет устойчивость эритроцитов к деформации, уменьшает тромбооб-разование и нормализует микроциркуляцию. Использование теофиллина осложняется его взаимодействием с различными лекарственными препаратами, поэтому его использование должно контролироваться измерениями концентрации теофиллина в сыворотке крови для избежания проявления токсичных эффектов. Он также может вызвать тошноту, диарею, увеличить ЧСС, аритмию и возбуждение ЦНС (головные боли, бессонница, раздражи-мость, головокружение и предобмо-рочное состояние). При особо высоких токсичных концентрациях могут возникнуть судороги. Кроме припадков, важным побочным эффектом препарата являются тахиаритмии.
Теофиллин содержится в бобах какао. Следовые количества теофиллина также находятся в заваренном чае. Теофиллин распреде-ляется в межклеточной жидкости, в плаценте, в молоке и ЦНС. Метаболизм теофиллина происходит главным образом в печени (до 70 %). Теофиллин выводится в неизменном виде с мочой (до 10 %).
Теоброми́н (в переводе с латинского «какао») — алкалоид пуринового ряда, изомерен тиофиллину. Бесцветные кристаллы горького вкуса, нерастворимые в воде. Выделен А.А.Воскресенским в 1841году из семян какао-бобов. Точный состав и гомология с кофеи-ном была установлена в 1847 году Карлом Эдуардом Глассоном из Санкт-Петербурга. Синтетически был получен Германом Фише-ром в 1882 году. Кроме какао, где теобромин (1,5 %) содержится вместе с кофеином, он находится также в небольших количествах в орехах кола и в некоторых видах падубовых.
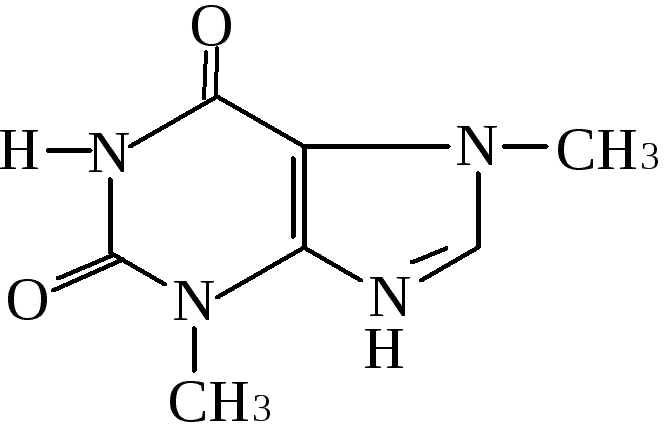
Теобромин представляет собой белый кристаллический порошок слегка горького вкуса, не разлагается на воздухе и при 100 °C; при 250 °C начинает чернеть и при 290—295 °C возгорается; плавится при 329—330 °C. Нерастворим в лигроине, немного растворим в воде (1 ч. в 1600 ч. воды) и ещё менее — в спирте, эфире, бензоле и хлороформе. Теобромин является слабым основанием; он соеди-няется и с кислотами, и с основаниями. С кислотами он даёт ряд хорошо кристаллизующихся, но непрочных солей, разлагающихся от кипячения в воде или спирте. Из металлических производных наиболее важно теоброминовое серебро C7H7N4О2Ag, с помощью ко-торого устанавливается связь теобромина с кофеином и ксантином.
Теобромин применяется для лечения бронхолёгочных заболеваний. Доказано, что теобромин, близкий по химическому составу к кофеину, имеет с ним аналогичное действие, вызывая возбуждение сердечной мышцы и увеличивая количество мочи путём раздра-жения почечного эпителия.На сегодняшний день теобромин применяется в зубных пастах для обеспечения реминерализации эмали. Он увеличивает твёрдость эмали, что, теоретически, увеличивает устойчивость в отношении кариеса.
Для добывания теобромина в чистом виде употребляются либо растёртые семена какао, освобождённые от жира, или спадающая на шоколадных фабриках пыль какао. Количество теобромина в шоколаде слишком мало́ для отравления человека. Чтобы вызвать ин-токсикацию, его концентрация должна достигнуть минимум 1000 мг на ки-лограмм массы тела. В 100 г молочного шоколада содер-жится 150–220 мг теобромина. Таким образом, отравление человека массой 80 кг наступит при съедании около 40 кг молочного шо-колада. Однако животные, у которых метаболизм теобромина происходит медленнее, вполне могут отравиться шоколадом. Наи-более частыми жертвами отравления становятся собаки, с возможным летальным исходом (средняя летальная доза для них состав-ляет 300 мг/кг). Кошки (и особенно котята) ещё более чувствительны к теобромину (средняя летальная доза — 200 мг/кг).
Нитрофура́л распространенный синоним — фурацили́н — антисептическое средство местного действия, относится к группе нитрофу-ранов. Обладает противомикробным действием. Используется как жидкость для промывания и очищения ран, благодаря своим антисептическим свойствам замедляет или останавливает рост микробной флоры.
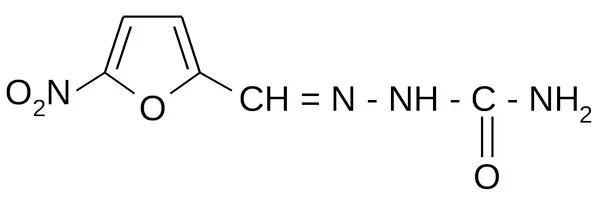
В некоторых европейских странах, а также в Северной Америке, это средство считается устаревшим и не применяется для лечения людей. Тем не менее оно до сих пор находит применение в ветеринарии.
Нитрофурал представляет собой мелкокристаллический порошок жёлтого или жёлто-зелёного цвета горького вкуса. Очень мало растворим в воде (при нагревании растворимость повышается), мало растворим в спирте, растворим в щелочах, практически нерастворим в эфире. Нитрофурановые соединения чувствительны к свету, поэтому разбавленные растворы следует оберегать от дневного света, особенно сильное влияние оказывает ультрафиолетовое излучение, приводящее к глубокому и необратимому разрушению молекулы.
Нитрофурал является противомикробным средством. Активен в отношении грамотрицательных и грамположительных бактерий: Streptococcus spp, Staphylococcus spp, Shigella flexneri spp, Shigella dysenteria spp, Salmonella spp, Shigella sonnei spp, Shigella boydii spp, Clostridium perfringens, Escherichia coli и др. У микроорганизмов устойчивость к препарату развивается медленно и высокой степени не достигает.
Фурацилин применяют при свежих и гнойных ранах, при ожогах II—III степени, при пролежнях, для промывания полостей, при мелких повреждениях кожи.
Нитрофурал включен в список токсических веществ в Калифорнии и предполагается, что он является канцерогеном для человека. Длительное применение нитрофурала может вызвать рак.
Феназо́н (торговая марка: «Антипирин») — лекарственное средство, анальгетик и антипиретик из группы пиразолонов.
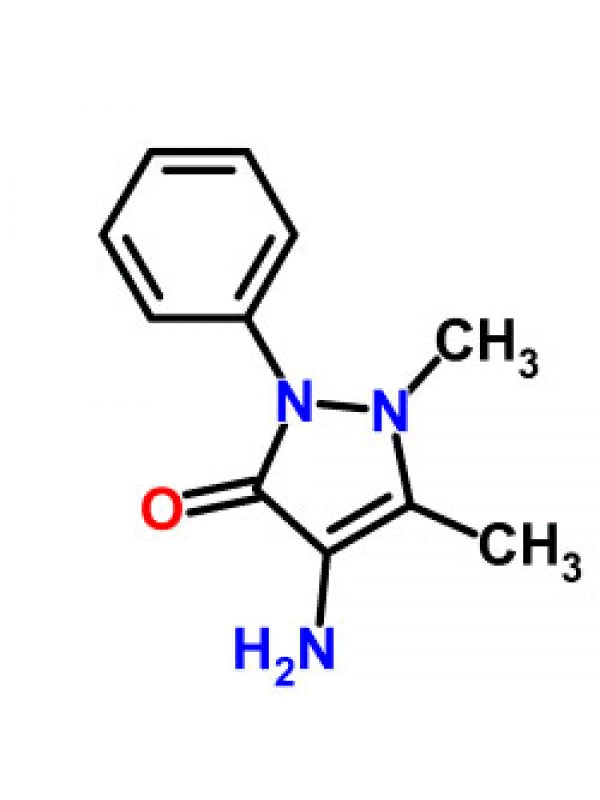
Антипирин оказывает болеутоляющее, жаропонижающее и в какой-то степени противовоспалительное действие. Препараты этой группы близки к производным салициловой кислоты. Производные пиразолона уменьшают проницаемость капилляров и препят-ствуют развитию воспалительной реакции. При местном применении антипирина отмечается некоторое кровоостанавливающее действие. Применяют антипирин при невралгиях, простудных заболеваниях. В организме антипирин метаболизирует медленнои выводится в виде конъюгата с глюкуроновой кислотой. Это бесцветные кристаллы или белый кристаллический порошок без за-паха, слабогорького вкуса. Очень легко растворим в воде (1:1), легко — в спирте. Растворы (рН 6,0—7,5) стерилизуют при +120 °C в течение 20 мин. Синтезирован Людвигом Кнорром в 1883 году.
Амидопирин или 1- фенил-2, 3-диметил-4-диметиламинопиразолон-5.

Белые кристаллы или белый кристаллический порошок без запаха, слабогорького вкуса. Медленно растворим в воде (1:20), растворим в спирте, очень легко растворим в хлороформе.
Оказывает жаропонижающее, болеутоляющее и противовоспалительное действие. По фармакологическим свойствам амидопирин близок к антипирину, но активнее его. Применяют при головной боли, невралгиях, артритах, миозитах, хорее, иногда при остром суставном ревматизме.
Анальгин -1- фенил-2, 3-диметил-4-метиламинопиразолон-5-N-метансульфонат натрия.

Белый или белый с едва заметным желтоватым оттенком крупноигольчатый, кристаллический порошок без запаха. В присутствии влаги быстро разлагается. Водные растворы при стоянии желтеют. Легко растворим в воде (1: 1,5), трудно — в спирте, нерастворим в эфире, хлороформе и ацетоне.
Применяют анальгин при болях различного происхождения (головная боль, невралгия, радикулиты, миозиты), лихорадочных состояниях, гриппе, ревматизме.
Бендазол, дибазол — 2- фенилметил-1H-бензимидазол — устаревшее лекарственное средство вазодилатирующего и иммуности-мулирующего действия, а также сосудорасширяющего и спазмолитического действия. При острых инфекциях препарат не оказы-вает лечебного действия, но действует профилактически.

Барбитураты (barbiturate) — группа лекарственных средств, производных барбитуровой кислоты, оказывающих угнетающее влияние на ЦНС. В зависимости от дозы их эффект может варьироваться от состояния лёгкого успокоения до наркоза. Ранее барбитураты широко назначались в качестве успокаивающих и снотворных средств. В настоящее время сфера их применения существенно ограничена. Барбитуровая кислота, производными которой являются барбитураты, была открыта немецким химиком Адольфом фон Байером 4 декабря 1864 года, в праздник святой Варвары (отсюда, как предполагается, происходит название этих препаратов: ураты Барбары — барбитураты). В медицинскую практику барбитураты впервые были введены в 1903 году, когда барбитал получил рыночное название «веронал». Вскоре препарат стал часто использоваться в качестве успокоительного и в качестве первого снотворного средства. Использование барбитуратов в медицине активно происходило до 1960-х годов, но заметно снизилось в последующие годы. Взлёт и падение использования барбитуратов имело несколько причин. Среди множества недугов, познанных человечеством в двадцатом веке, бессонница и тревожное состояние были наиболее частыми. Поэтому данный лекарственный препарат имел огромную популярность и объясняло их преобладание на рынке. Однако при длительном применении они вызывали привыкание и лекарственную зависимость, что привело к постепенному отказу от их назначения в пользу более безопасных бензодиазепинов.

Всего было синтезировано более 2500 барбитуратов. Около 50 препаратов имелось в коммерческой продаже. В настоящее время в продаже остались около десяти. В соответствии с рекомендациями ВОЗ при именовании барбитуратов снотворного действия используется основа -барб-, при этом часто используется суффикс -ал (секобарбитал, пентобарбитал и т.д.).
Эффекты от применения различных барбитуратов совпадают, но они различаются по величине и продолжительности действия. Барбитураты классифицируются на следующие виды: ультракороткого и непродолжительного действия, средней продолжитель-ности и длительного действия. Например, пентобарбитал и секобарбитал являются сильными, быстродействующими препаратами (продолжительностью от двух до четырёх часов), амобарбитал — препарат средней продолжительности действия (от шести до восьми часов), и фенобарбитал — длительного действия (восемь — десять часов).
Барбитураты оказывают дозозависимое угнетающее влияние на центральную нервную систему: от состояния лёгкой седации до комы. В настоящее время их применение ограничено: назначаются в качестве противосудорожных средств и средств для ввод-ного наркоза. Ветеринарные врачи используют пентобарбитал как обезболивающее средство и средство для эвтаназии.
В умеренных дозах барбитураты вызывают состояние эйфории, близкое к состоянию опьянения. По аналогии с алкоголем, барби-тураты могут вызывать потерю координации, нетвердую походку и невнятную речь. Барбитураты нарушают концентрацию вни-мания, память и способность к обучению.
Кофеи́н ( матеин, теин, гуаранин) — алкалоид пуринового ряда, бесцветные или белые горькие кристаллы. Является психоактив-ным веществом, содержится в кофе, чае, мате, входит в состав энергетиков и многих прохладительных напитков. Также входит в состав аптечных препаратов. Кофеин содержится в растениях: кофе, чайных листьях, бобах какао, гуарана и некоторых других. Он синтезируется растениями для защиты от насекомых, поедающих листья, стебли и зёрна, а также для поощрения опылителей.
У животных и человека кофеин стимулирует ЦНС, усиливает сердечную деятельность, ускоряет пульс, вызывает расширение кро-веносных сосудов (преимущественно сосудов скелетных мышц, головного мозга (сужает просвет мозговых артерий), сердца, по-чек), усиливает мочеотделение, снижает агрегацию тромбоцитов (однако в некоторых случаях отмечаются противоположные эф-фекты). В медицине кофеин применяется в составе средств от головной боли, при мигрени, как стимулятор дыхания и сердечной деятельности при простудных заболеваниях, для повышения умственной и физической работоспособности, для устранения сон-ливости.

Кофеин открыл в 1819 году и дал ему название немецкий химик Фердинанд Рунге. В чистом виде кофеин впервые выделили Пьер Пеллетье и Жозеф Каванту в 1828 году. В 1832 году его состав был установлен Ф.Велером и Х.Г. Пфаффом с Ю.Либихом. Химичес-кая структура молекулы кофеина была выяснена к концу XIX века Г.Э.Фишером, который впервые искусственно синтезировал кофеин. Химическое название кофеина — 1,3,7-триметилксантин. В щелочной среде (при рН >9), превращается в кофеидин C7H12N4O. По строению и фармакологическим свойствам кофеин близок к теобромину и теофиллину. Белые игольчатые крис-таллы горьковатого вкуса, без запаха. Хорошо растворим в хлороформе, плохо растворим в холодной воде (1:60), легко — в горячей (1:2), трудно растворим в этаноле (1:50). Растворы имеют нейтральную реакцию.
В микродозах кофеин оказывает стимулирующее воздействие на нервную систему. При длительном применении может вызывать слабую зависимость-теизм. В больших дозах вызывает истощение, а в дозах 150—200 мг на килограмм массы тела (80—100 чашек кофе за ограниченный промежуток времени, зависящий от индивидуальных, физиологических свойств организма, 1-2 часа) — летальный исход. Под воздействием кофеина ускоряется сердечная деятельность, поднимается кровяное давление, примерно на 40 минут улучшается настроение, за счёт высвобождения дофамина, но через 3—6 часов действие кофеина проходит: появляется усталость, вялость, снижение трудоспособности. Физиологические особенности действия кофеина на ЦНС были изучены И.П.Пав-ловым и его сотрудниками, показавшими, что кофеин усиливает и регулирует процессы возбуждения в коре головного мозга; в соответствующих дозах он усиливает положительные условные рефлексы такие как: память, концентрация внимания, скорость реакции и повышает двигательную активность. Стимулирующее действие приводит к повышению умственной и физической рабо-тоспособности, уменьшению усталости и сонливости. Большие дозы могут, однако, привести к истощению нервных клеток. Влия-ние кофеина (как и других психостимулирующих средств) на высшую нервную деятельность в значительной степени зависит от типа нервной системы. Поэтому дозирование кофеина должно производиться с учётом индивидуальных особенностей нервной деятельности. Кофеин ослабляет действие снотворных и опиатов и усиливает действие психостимуляторов, повышает рефлек-торную возбудимость спинного мозга, возбуждает дыхательный и сосудодвигательный центры. Сердечная деятельность под влиянием кофеина усиливается, сокращения миокарда становятся более интенсивными и учащаются.
НУКЛЕИНОВЫЕ КИСЛОТЫ.
Нуклеиновые кислоты (НК) — природные высокомолекулярные соединения (биополимеры), макромолекулы которых состоят из большого числа нуклеотидов.
Существует два вида нуклеиновых кислот:

Схемы полного гидролиза РНК и ДНК, которые позволяют делать вывод о химическом составе НК:

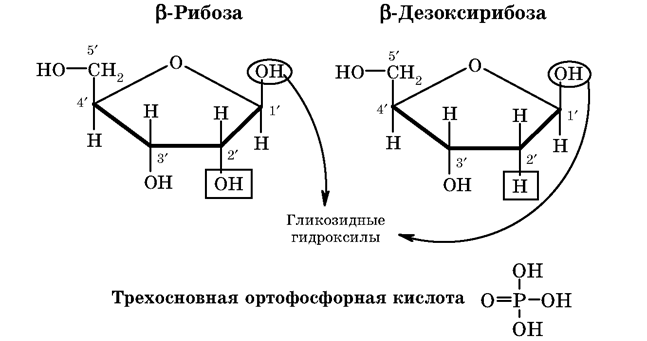
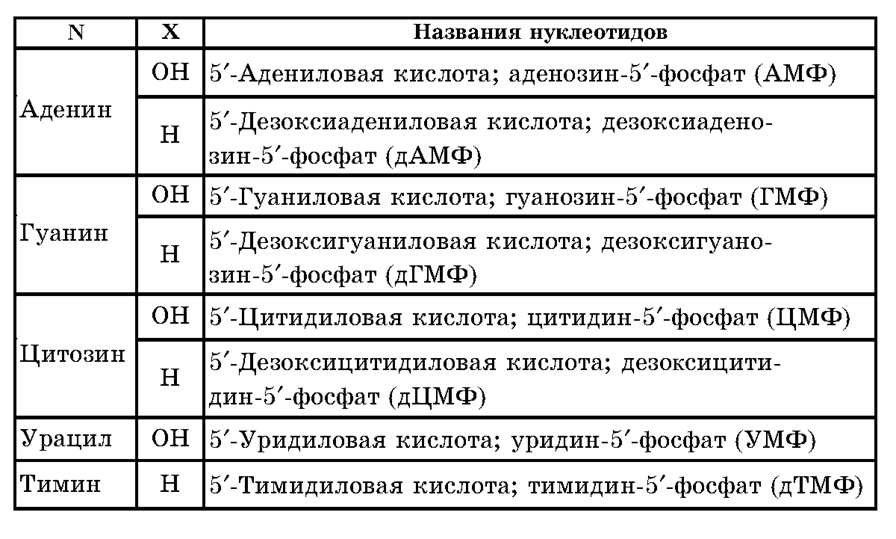
Результаты гидролиза НК свидетельствуют о том, что в их состав входят остатки гетероциклических азотистыхоснований (пирими-диновых и пуриновых), пентоз (в-рибозы и в-дезоксирибозы) и ортофосфорной кислоты. В состав нуклеотидов, структурных звеньев НК, входят гетероциклические азотистые основания: — аденин (А) и гуанин (Г) — производные пурина; — цитозин (Ц), урацил (У), тимин (Т)- производные пиримидина.)

Для всех этих оснований (кроме аденина) характерно явление таутомерии. Каждое основание может существовать в енольной форме (в структуре имеется двойная связь (ен) и гидроксильная группа (ол) у одного атома углерода) и в кето-форме (в структуре имеется связь С=О). Этот вид таутомерии называется кето-енольной таутомерией.
В состав нуклеиновых кислот урацил, тимин, цитозин и гуанин входят в кетоформе.
Формулы других структурных компонентов нуклеиновых кислот:
Образование нуклеозидов.
Нуклеозиды — продукты конденсации пиримидиновых или пуриновых оснований с β-рибозой или β-дезоксирибозой за счет обра-зования β-гликозидных связей между атомом С(1′) пентозы и атомом N(1) пиримидиновых или атомом N(9) пуриновых оснований.

Образование нуклеотидов.
Соединяясь с фосфорной кислотой , нуклеозид образует нуклеотид:

Нуклеотиды — сложные эфиры нуклеозидов и фосфорной кислоты. В этерифи-кации обычно участвует ОН-группа у атома С(5′) β-рибозы или β-дезоксирибозы (иногда в образовании нуклеотидов участвует ОН-группа у атома С(3′)).
Общая формула нуклеотидов:

Первичная структура НК
Под первичной структурой ДНК и РНК понимают последовательность мононуклеотидов в полинуклеотидной цепи. Отдельные нуклеотидные остатки связаны между собой в полинуклеотидных цепях 3′-5′-фосфодиэфирными связями. Ниже приведены фрагменты первичных структур ДНК и РНК, каждый из которых содержит 4 различных нуклеотида:

Против одной цепи нуклеотидов ДНК располагается вторая цепь. Расположение нуклеотидов в этих двух цепях не случайное, а строго определенное: против аденина одной цепи в другой цепи всегда располагается тимин, а против гуанина — всегда цитозин, между аденином и тимином возникают две водородные связи, между гуанином и цитозином — три водородные связи. Закономер-ность, согласно которой нуклеотиды разных цепей ДНК строго упорядоченно располагаются (аденин — тимин, гуанин — цитозин) и избирательно соединяются друг с другом, называется принципом комплементарности. Следует отметить, что Дж. Уотсон и Ф. Крик пришли к пониманию принципа комплементарности после ознакомления с работами Э. Чаргаффа, который изучив огромное ко-личество образцов тканей и органов различных организмов, установил, что в любом фрагменте ДНК содержание остатков гуанина всегда точно соответствует содержанию цитозина, а аденина — тимину («правило Чаргаффа»). Из принципа комплементарности следует, что последовательность нуклеотидов одной цепи определяет последовательность нуклеотидов другой. Цепи ДНК антипа-раллельны (разнонаправлены), т.е. нуклеотиды разных цепей располагаются в противоположных направлениях, и, следовательно, напротив 3′-конца одной цепи находится 5′-конец другой. Молекулу ДНК иногда сравнивают с винтовой лестницей. «Перила» этой лестницы — сахарофосфатный остов (чередующиеся остатки дезоксирибозы и фосфорной кислоты); «ступени» — комплементарные азотистые основания.
Трёхмерная структура ДНК.
Пространственная структура ДНК — это комплекс двух полинуклеотидных цепей, закрученных относительно общей оси, так что углевод-фосфатные цепи составляют периферию молекулы, а азотсодержащие гетероциклы направлены внутрь (двойная спираль Уотсона—Крика). Двойная спираль существует за счет водородных связей, которые образуются между комплементарными азотистыми основаниями.
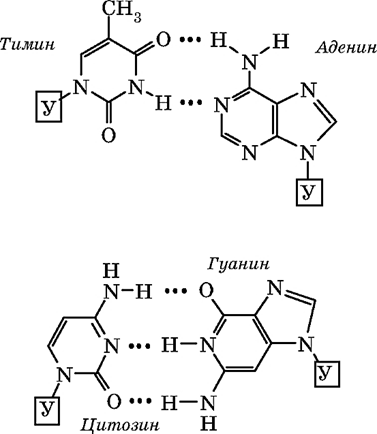
Биологическая роль нуклеиновых кислот.
ДНК
Содержатся в ядрах клеток. Важнейшая функция ДНК — хранение и передача наследственных признаков. При делении клеток двойная спираль ДНК раскручивается и разделяется на две цепи. На каждой отдельной цепи, как на матрице, происходит биосин-тез новой цепи ДНК с учетом принципа комплементарности. В результате воссоздаются две новые двойные спирали ДНК. Этот процесс репликации лежит в основе обеспечения дочерних клеток молекулами ДНК, идентичными с ДНК родительских клеток. Генетическая информация, т. е. информация о синтезе определенных белков, закодирована в нуклеотидной последовательности ДНК. Одну аминокислоту кодирует трехнуклеотидная последовательность (кодон).
Репликация ДНК — процесс самоудвоения, главное свойство молекулы ДНК. Репликация относится к категории реакций матрич-ного синтеза, идет с участием ферментов. Под действием ферментов молекула ДНК раскручивается, и около каждой цепи, выступа-ющей в роли матрицы, по принципам комплементарности и антипараллельности достраивается новая цепь. Таким образом, в каждой дочерней ДНК одна цепь является материнской, а вторая — вновь синтезированной. Такой способ синтеза называется полуконсервативным. «Строительным материалом» и источником энергии для репликации являются дезоксирибонуклеозид-трифосфаты (АТФ, ТТФ, ГТФ, ЦТФ), содержащие три остатка фосфорной кислоты. При включении дезоксирибонуклеозидтрифос-фатов в полинуклеотидную цепь два концевых остатка фосфорной кислоты отщепляются, и освободившаяся энергия используется на образование фосфодиэфирной связи между нуклеотидами.
В репликации участвуют следующие ферменты:
- геликазы («расплетают» ДНК);
- дестабилизирующие белки;
- ДНК-топоизомеразы (разрезают ДНК);
- ДНК-полимеразы (подбирают дезоксирибонуклеозидтрифосфаты и комплементарно присоединяют их к матричной цепи ДНК);
- РНК-праймазы (образуют РНК-затравки, праймеры);
- ДНК-лигазы (сшивают фрагменты ДНК).
С помощью геликаз в определенных участках ДНК расплетается, одноцепочечные участки ДНК связываются дестабилизирующими белками, образуется репликационная вилка. При расхождении 10 пар нуклеотидов (один виток спирали) молекула ДНК должна совершить полный оборот вокруг своей оси. Чтобы предотвратить это вращение ДНК-топоизомераза разрезает одну цепь ДНК, что дает ей возможность вращаться вокруг второй цепи.
ДНК-полимераза может присоединять нуклеотид только к 3′-углероду дезоксирибозы предыдущего нуклеотида, поэтому данный фермент способен передвигаться по матричной ДНК только в одном направлении: от 3′-конца к 5′-концу этой матричной ДНК. Так как в материнской ДНК цепи антипараллельны, то на ее разных цепях сборка дочерних полинуклеотидных цепей происходит по-разному и в противоположных направлениях. На цепи 3’–5′ синтез дочерней полинуклеотидной цепи идет без перерывов; эта дочерняя цепь будет называться лидирующей. На цепи 5’–3′ — прерывисто, фрагментами (фрагменты Оказаки), которые после завершения репликации ДНК-лигазами сшиваются в одну цепь; эта дочерняя цепь будет называться запаздывающей (отстаю-щей).
Особенностью ДНК-полимеразы является то, что она может начинать свою работу только с «затравки» (праймера). Роль «затра-вок» выполняют короткие последовательности РНК, образуемые при участи фермента РНК-праймазы и спаренные с матричной ДНК. РНК-затравки после окончания сборки полинуклеотидных цепочек удаляются.
Репликация протекает сходно у прокариот и эукариот. Скорость синтеза ДНК у прокариот на порядок выше (1000 нуклеотидов в секунду), чем у эукариот (100 нуклеотидов в секунду). Репликация начинается одновременно в нескольких участках молекулы ДНК. Фрагмент ДНК от одной точки начала репликации до другой образует единицу репликации — репликон.
Репарацией называется процесс устранения повреждений нуклеотидной последовательности ДНК. Осуществляется особыми фер-ментными системами клетки (ферменты репарации). В процессе восстановления структуры ДНК можно выделить следующие эта-пы: 1) ДНК-репарирующие нуклеазы распознают и удаляют поврежденный участок, в результате чего в цепи ДНК образуется брешь; 2) ДНК-полимераза заполняет эту брешь, копируя информацию со второй («хорошей») цепи; 3) ДНК-лигаза «сшивает» нуклеотиды, завершая репарацию.
Наиболее изучены три механизма репарации: 1) фоторепарация, 2) эксцизная, или дорепликативная, репарация, 3) постреплика-тивная репарация.
Изменения структуры ДНК происходят в клетке постоянно под действием реакционно-способных метаболитов, ультрафиолетового излучения, тяжелых металлов и их солей и др. Поэтому дефекты систем репарации повышают скорость мутационных процессов, являются причиной наследственных заболеваний (пигментная ксеродерма, прогерия и др.).
РНК
Находятся в рибосомах, а также в протоплазме клеток. РНК — полимер, мономерами которой являются рибонуклеотиды. В отличие от ДНК, РНК образована не двумя, а одной полинуклеотидной цепочкой (исключение — некоторые РНК-содержащие вирусы имеют двухцепочечную РНК). Нуклеотиды РНК способны образовывать водородные связи между собой. Цепи РНК значительно короче цепей ДНК.
Мономер РНК — нуклеотид (рибонуклеотид) — состоит из остатков трех веществ: 1) азотистого основания, 2) пятиуглеродного моносахарида (пентозы) и 3) фосфорной кислоты. Азотистые основания РНК также относятся к классам пиримидинов и пуринов.
Пиримидиновые основания РНК — урацил, цитозин, пуриновые основания — аденин и гуанин. Моносахарид нуклеотида РНК представлен рибозой.
Выделяют три вида РНК: 1) информационная (матричная, месенджер) РНК — иРНК (мРНК), 2) транспортная РНК — тРНК, 3) рибо-сомная РНК — рРНК.
Все виды РНК представляют собой неразветвленные полинуклеотиды, имеют специфическую пространственную конформацию и принимают участие в процессах синтеза белка. Информация о строении всех видов РНК хранится в ДНК. Процесс синтеза РНК на матрице ДНК называется транскрипцией.
Транспортные РНК (тРНК) переносят аминокислоты из цитоплазмы к месту синтеза белка- в рибосомы. Число тРНК превышает число α-аминокислот, участвующих в построении белков, поскольку некоторые аминокислоты переносятся не одной, а несколь-кими тРНК. Матричные (или информационные) РНК копируют генетическую информацию и переносят ее к месту биосинтеза белков.
Транспортные РНК содержат обычно 76 (от 75 до 95) нуклеотидов; молекулярная масса — 25 000–30 000. На долю тРНК приходится около 10% от общего содержания РНК в клетке. Функции тРНК: 1) транспорт аминокислот к месту синтеза белка, к рибосомам, 2) трансляционный посредник. В клетке встречается около 40 видов тРНК, каждый из них имеет характерную только для него после-довательность нуклеотидов. Однако у всех тРНК имеется несколько внутримолекулярных комплементарных участков, из-за кото-рых тРНК приобретают конформацию, напоминающую по форме лист клевера. У любой тРНК есть петля для контакта с рибосомой (1), антикодоновая петля (2), петля для контакта с ферментом (3), акцепторный стебель (4), антикодон (5). Аминокислота присоеди-няется к 3′-концу акцепторного стебля. Антикодон — три нуклеотида, «опознающие» кодон иРНК. Следует подчеркнуть, что конк-ретная тРНК может транспортировать строго определенную аминокислоту, соответствующую ее антикодону. Специфичность соединения аминокислоты и тРНК достигается благодаря свойствам фермента аминоацил-тРНК-синтетаза.
Рибосомные РНК содержат 3000–5000 нуклеотидов; молекулярная масса — 1 000 000–1 500 000. На долю рРНК приходится 80–85% от общего содержания РНК в клетке. В комплексе с рибосомными белками рРНК образует рибосомы — органоиды, осуществляю-щие синтез белка. В эукариотических клетках синтез рРНК происходит в ядрышках. Функции рРНК: 1) необходимый структурный компонент рибосом и, таким образом, обеспечение функционирования рибосом; 2) обеспечение взаимодействия рибосомы и тРНК; 3) первоначальное связывание рибосомы и кодона-инициатора иРНК и определение рамки считывания, 4) формирование активного центра рибосомы.
Информационные РНК разнообразны по содержанию нуклеотидов и молекулярной массе (от 50 000 до 4 000 000). На долю иРНК приходится до 5% от общего содержания РНК в клетке. Функции иРНК: 1) перенос генетической информации от ДНК к рибосомам, 2) матрица для синтеза молекулы белка, 3) определение аминокислотной последовательности первичной структуры белковой молекулы.
СТРУКТУРА И БИОЛОГИЧЕСКАЯ РОЛЬ АДЕНОЗИНФОСФОРНЫХ КИСЛОТ.
Аденозинфосфорные кислоты (адениновые рибонуклеотиды) — производные аденозина, содержащие остатки ортофосфорной или полифосфорных кислот. Особо важное биологическое значение имеют аденозин-5′-фосфорные кислоты: n=1 Аденозинмонофосфорная кислота (АМФ) n=2 Аденозиндифосфорная кислота (АДФ) n=3Аденозинтрифосфорная кислота (АТФ)

У человека скорость обмена АТФ составляет около 50 кг в сутки. Такая интенсивность обмена объясняется тем, что этот нуклеотид занимает центральное место в энергетике организма. Сокращение мышц, биосинтез белков и нуклеиновых кислот, многие другие процессы протекают за счет энергии, выделяющейся при гидролизе АТФ:
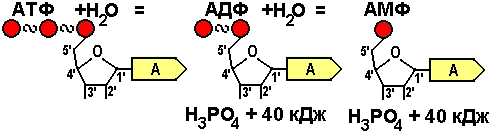
Строение АТФ.
В любой клетке нашего организма протекают миллионы биохимических реакций. Они катализируются множеством ферментов, которые зачастую требуют затрат энергии. АТФ расшифровывается как аденозинтрифосфат, или аденозинтрифосфорная кислота. Вещество является одним из двух наиболее важных источников энергии в любой клетке. Строение АТФ и биологическая роль тесно связаны. Большинство биохимических реакций может протекать только при участии молекул вещества, особенно это касается пластического обмена. Однако АТФ редко непосредственно участвует в реакции: для протекания любого процесса нужна энергия, заключенная именно в химических связях аденозинтрифосфата. Образующиеся связи между фосфатными группами несут огром-ное количество энергии. Поэтому такие связи также называются макроэргическими, или макроэнергетическими (макро=много, большое количество). Этот термин ученый Ф. Липман, и он же предложил использовать значок ~ для их обозначения.

Очень важно для клетки поддерживать постоянный уровень содержания аденозинтрифосфата. Особенно это характерно для кле-ток мышечной ткани и нервных волокон, потому что они наиболее энергозависимы и для выполнения своих функций нуждаются в высоком содержании аденозинтрифосфата.
Строение молекулы АТФ
Аденозинтрифосфат состоит из трех элементов: рибозы, азотистого основания и трёх остатков фосфорной кислоты.

Рибоза – углевод, который относится к группе пентоз. Это значит, что в составе рибозы 5 атомов углерода, которые заключены в цикл. Рибоза соединяется с аденином β-N-гликозидной связь на 1-ом атоме углерода. Также к пентозе присоединяются остатки фосфорной кислоты на 5-ом атоме углерода.
Аденин – азотистое основание. В зависимости от того, какое азотистое основание присоединяется к рибозе, выделяют также ГТФ (гуанозинтрифосфат), ТТФ (тимидин-трифосфат), ЦТФ (цитидинтрифосфат) и УТФ (уридинтрифосфат). Все эти вещества схожи по строению с аденозинтрифосфатом и выполняют примерно такие же функции, однако они встречаются в клетке намного реже.
Остатки фосфорной кислоты. К рибозе может присоединиться максимально три остатка фосфорной кислоты. Если их два или только один, то соответственно вещество называется АДФ (дифосфат) или АМФ (монофосфат). Именно между фосфорными остат-ками заключены макроэнергетические связи, после разрыва которых высвобождается от 40 до 60 кДж энергии. Если разрываются две связи, выделяется 80, реже – 120 кДж энергии. При разрыве связи между рибозой и фосфорным остатком выделяется всего лишь 13,8 кДж, поэтому в молекуле трифосфата только две макроэргические связи (Р ~Р~ Р), а в молекуле АДФ — одна (Р~ Р).
Кроме энергетической, АТФ может выполнять множество других функций в клетке. Наряду с другими нуклеотидтрифосфатами трифосфат участвует в построении нуклеиновых кислот. В этом случае АТФ, ГТФ, ТТФ, ЦТФ и УТФ являются поставщиками азотистых оснований. Это свойство используется в процессах репликации ДНК и транскрипции.
Также АТФ необходим для работы ионных каналов. Например, Na-K канал выкачивает 3 молекулы натрия из клетки и вкачивает 2 молекулы калия в клетку. Такой ток ионов нужен для поддержания положительного заряда на наружной поверхности мембраны, и только с помощью аденозинтрифосфата канал может функционировать. То же касается протонных и кальциевых каналов.
Как образуется АТФ в клетке.
Функции и строение АТФ таковы, что молекулы вещества быстро используются и разрушаются. Поэтому синтез трифосфата – это важный процесс образования энергии в клетке. Выделяют три наиболее важных способа синтеза аденозинтрифосфата: 1. Субстратное фосфорилирование. 2. Окислительное фосфорилирование. 3. Фотофосфорилирование.
Субстратное фосфорилирование основано на множественных реакциях, протекающих в цитоплазме клетки. Эти реакции получили название гликолиза – анаэробный этап аэробного дыхания. В результате 1 цикла гликолиза из 1 молекулы глюкозы синтезируется две молекулы пировиноградной кислоты которые дальше используются для получения энергии, и также синтезируются два АТФ.
С6Н12О6 + 2АДФ + 2Фн ––> 2С3Н4O3 + 2АТФ + 4Н.
Окислительное фосфорилирование – это образование аденозинтрифосфата путем передачи электронов по электронно-транспор-тной цепи мембраны. В результате такой передачи формируется градиент протонов на одной из сторон мембраны и с помощью белкового интегрального комплекта АТФ-синтазы идет построение молекул. Процесс протекает на мембране митохондрий.
Последовательность стадий гликолиза и окислительного фосфорилирования в митохондриях составляет общий процесс под названием дыхание. После полного цикла из 1 молекулы глюкозы в клетке образуется 36 молекул АТФ.
Процесс фотофосфорилирования — это то же окислительное фосфорилирование лишь с одним отличием: реакции фотофосфорили-рования протекают в хлоропластах клетки под действием света. АТФ образуется во время световой стадии фотосинтеза – основного процесса получения энергии у зеленых растений, водорослей и некоторых бактерий.
В процессе фотосинтеза все по той же электронно-транспортной цепи проходят электроны, в результате чего формируется про-тонный градиент. Концентрация протонов на одной из сторон мембраны является источником синтеза АТФ. Сборка молекул осу-ществляется посредством фермента АТФ-синтазы.
Интересные факты об АТФ.
— В среднестатистической клетке содержится 0,04% аденозинтрифосфата от всей массы. Однако самое большое значение наблюда-ется в мышечных клетках: 0,2-0,5%. — В клетке около 1 млрд молекул АТФ. — Каждая молекула живет не больше 1 минуты. — Одна молекула аденозинтрифосфата обновляется в день 2000-3000 раз. — В сумме за сутки организм человека синтезирует 40 кг аденозинтрифосфата, и в каждый момент времени запас АТФ составляет 250 г.


0 Комментариев