АЛКИНЫ.
Атомы углерода способны образовывать друг с другом не только двойные, но и тройные связи. Такие углеводороды также являются ненасыщенными, однако их свойства значительно отличаются от свойств алкенов и алкадиенов. Алкины (ацетиленовые углеводороды) — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь.
Углеводороды ряда ацетилена являются еще более непредельными соединениями, чем соответствующие им алкены, с тем же числом углеродных атомов. Это видно из сравнения числа атомов водорода в ряду.
Оглавление
Строение молекулы.
Рассмотрим особенности строения алкинов на примере ацетилена. В молекуле ацетилена присутствуют химические связи C–H и С≡С. Связь C–H ковалентная слабополярная одинарная σ-связь. Связь С≡С – тройная, ковалентная неполярная, одна из связей σ, еще две: π-связи. Атомы углерода при тройной связи образуют по две σ-связи и две π-связи. Следовательно, гибридизация атомов углерода при тройной связи в молекулах алкинов – sp:

При образовании σ-связи между атомами углерода происходит перекрывание sp-гибридных орбиталей атомов углерода:

При образовании π-связи между атомами углерода происходит перекрывание негибридных орбиталей атомов углерода:

Две sp-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому две гибридные орбитали атомов углерода при тройной связи в алкинах направлены в пространстве под углом 180о друг к другу:

Молекулам алкинов с большим числом атомов углерода соответствует пространственное строение, т.к. в их молекулах присутствуют атомы углерода в sp3-гибридном состоянии, в составе метильного фрагмента СН3. Такой фрагмент имеет тетраэдрическое строение.
Гомологический ряд.
Первый представитель гомологического ряда алкенов – этин (ацетилен) C2H2, или СH≡СH. Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь.
| Название алкина | Формула алкина |
| Этин (ацетилен) | C2H2 |
| Пропин | C3H4 |
| Бутин | C4H6 |
| Пентин | C5H8 |
| Гексин | C6H10 |
| Гептин | C7H12 |

Первые три члена гомологического ряда алкинов – газы, начиная с C5Н8 по С16Н30 – жидкости, начиная с С17Н32 — твердые вещества. Алкины плохо растворимы в воде и хорошо растворимы в органических растворителях.
Изомерия.
Для алкинов характерна структурная и пространственная изомерия.
Структурная изомерия. Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связыва-ния атомов в молекуле, т.е. строением молекул. —изомерия углеродного скелета. Изомеры углеродного скелета отличаются строением углеродного скелета. Изомеры с различным углеродным скелетом и с формулой С5Н8 — пентин-1 и 3-метилбутин-1:

—изомерия положения кратной связи. Изомеры положения тройной связи, которые соответствуют формуле С5Н8 — пентин-1 и пентин-2:

—межклассовая изомерия. Межклассовыми изомерами являются вещества разных классов с различным строением, но одинаковым составом. Алкины являются межклассовыми изомерами с алкадиенами. Общая формула алкинов и алкадиенов — CnH2n-2. Межклассовые изомеры с общей формулой С4Н6 — бутин-1 и бутадиен-1,3.

Пространственная изомерия.
—оптическая изомерия. Характерна для некоторых алкинов. Алкины, которые обладают достаточно большим углеродным скелетом, могут существовать в виде оптических изомеров. В молекуле алкина должен присутствовать асимметрический атом углерода (атом углерода, связанный с четырьмя различными заместителями).
— цис-транс—изомерия для алкинов не характерна, так как по тройной связи вращение возможно.
Номенклатура.
В названиях алкинов для обозначения тройной связи используется суффикс — ин, в конце названия через дефис указывается номер атома углерода, у которого располагается тройная связь. Алкин, имеющий название бутин-2, имеет структурную формулу:

Для простейших алкинов применяются также исторически сложившиеся (тривиальные) названия:
| Название алкина | Формула алкина |
| Ацетилен | CH≡CH |
| Пропин | CH≡C−CH3 |
| Бутин-1 | CH≡C−СH2−CH3 |
Радикалы, содержащие тройную связь, также носят тривиальные названия:
| Формула радикала | Тривиальное название |
| CH≡C− | этинил |
| CH≡C−CH2− | пропаргил |
Физические свойства алкинов.
- Плохо растворимы в воде
- С2 по С4 – газы
- С5 по С15 – жидкости
- С16 и т.д. — твердые вещества
Температуры кипения алкинов выше, чем у соответствующих алканов. Растворимость в воде незначительна, немного выше, чем у алканов и алкенов, но все равно очень мала. Растворимость в неполярных органических растворителях высокая.

Для лучшего усвоения учебного материала, посмотрите видео-урок по ссылке: https://youtu.be/70_YzIoFIDc
Получение ацетилена и других алкинов.
Алкины в природе не встречаются. Существуют следующие способы их получения.
1. Общий способ получения ацетилена и его гомологов — дегидрогалогенирование (отщепление двух молекул галогеноводорода) дигалогеналканов (в молекулах которых два атома галогена расположены у одного, либо у соседних атомов углерода) под действием спиртового раствора щёлочи при нагревании (1,1-дихлорпропан → пропин) :

2. Ацетилен в промышленности получают пиролизом метана при температуре :

Реакцию проводят, очень быстро пропуская метан между электродами (электродуговой способ) — примерно 0,1-0,01 секунды при температуре 1500оС. Если процесс проводить дольше, то метан разлагается на углерод и водород:

3. Существует карбидный метод получения ацетилена. Для этого сначала производят обжиг известняка, затем полученный оксид кальция сплавляют с углеродом, после чего образующийся карбид кальция обрабатывают водой. В настоящее время ацетилен из карбида кальция получают только в лаборатории. Лабораторный способ получения ацетилена – водный или кислотный гидролиз карбида кальция CaC2: СаС2 + 2Н2О = Са(ОН)2 + С2Н2 В кислой среде образуется ацетилен и соответствующая соль: CaC2 + 2HCl = CaCl2 + C2H2 Карбид кальция можно получить, нагревая оксид кальция с углеродом: СаО + 3С (изб) → СаС2 + СО
4. Алкилирование соединений алкинов с металлами. Ацетилениды, пропиниды и прочие соединения алкинов с металлами реагируют с галогеналканами с образованием гомологов алкинов. При этом происходит удлиннение исходной молекулы алкина (пропинид натрия реагирует с бромэтаном с образованием пентина-2):

5. Дегидрирование алканов. При дегидрировании алканов, содержащих от двух до трех атомов углерода в молекуле, образуются двойные и тройные связи (при дегидрировании этана может образоваться этилен или ацетилен):


Для лучшего усвоения учебного материала, посмотрите видео-урок по ссылке: https://youtu.be/W_DL-9BjwSA
Химические свойства алкинов.
Химические свойства алкинов объясняет наличие тройной связи в молекуле алкина. Типичная реакция для алкинов – реакция при-соединения, которая протекает в 2 стадии. На первой происходит присоединение и образование двойной связи, а на второй – присо-единение к двойной связи. Реакция у алкинов протекает медленнее, чем и алкенов, т.к. электронная плотность тройной связи «раз-мазана» более компактно, чем у алкенов, и поэтому менее доступна для реагентов. 1. Галогенирование. Галогены присоединяются к алкинам в 2 стадии. Например,

а суммарно:

Алкины также как и алкены обесцвечивают бромную воду, поэтому эта реакция является качественной и для алкинов.
2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи несколько труднее, чем к двойной. Для ускорения (активации) процесса используют сильную кислоту Льюиса – AlCl3. Из ацетилена при таких условиях можно получить винилхлорид, который идет на производства полимера – поливинилхлорида, имеющего важнейшее значение в промышлености:

Если же галогеноводород будет в избытке, то реакция (особенно у несимметричных алкинов) идет по правилу Марковникова:

3. Гидратация (присоединение воды). Реакция протекает только в присутствии солей ртути (II) в качестве катализатора:
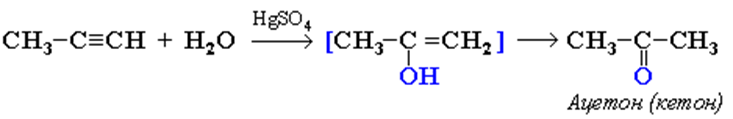
На 1ой стадии образуется непредельный спирт, в котором гидроксогруппа находится у атома углерода, образующего двойную связь. Такие спирты называются виниловыми или фенолами. Только ацетилен превращается в альдегид, его гомологи — в кетоны. Реакция протекает по правила Марковникова:

Эта реакция носит названия – реакции Кучерова.
4. Алкины, которые имеют концевую тройную связь, могут отщеплять протон под действием сильных кислотных реагентов. Такой процесс обусловлен сильной поляризацией связи. Причиной поляризации служит сильная электроотрицательность атома углерода в sp-гибридизации, поэтому алкины могут образовывать соли – ацетилениды:

Ацетилениды меди и серебра легко образуются и выпадают в осадок (при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди). Эти реакции являются качественными на концевую тройную связь:
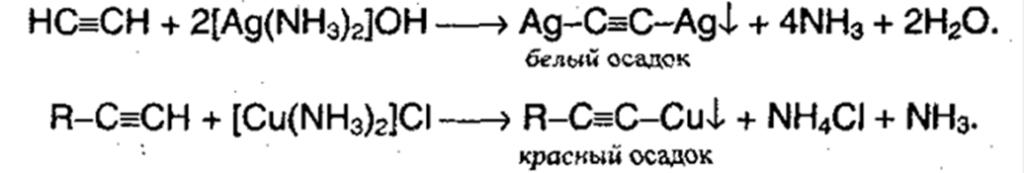
Полученные соли легко разлагаются под действием HCl, в результате выделяется исходный алкин:

Поэтому алкины легко выделить из смеси других углеводородоров.
5. Полимеризация. При участии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий, могут образовываться различные продукты. Например, под воздействием хлорида меди (I) и хлорида аммония:

Винилацетилен (полученное соединение) присоединяет хлороводород, образуя хлоропрен, который служит сырьем для получения синтетического каучука:

6. Если ацетилен пропускать через уголь при 600 ºС, получают ароматическое соединение – бензол. Из гомологов ацетилена, получают гомологи бензола:

7. Реакция окисления и восстановления. Алкины легко окисляются пеманганатом калия. Раствор обесцвечивается, т.к. в исходном соединении есть тройная связь. При окислении происходит расщепление тройной связи с образованием карбоновой кислоты:

В присутствие металлических катализаторов происходит восстановление водородом:


Для лучшего усвоения учебного материала, посмотрите видео-урок по ссылке: https://youtu.be/C5zOCCNsnXU
Применение алкинов.
Алкины являются сырьем для производства большого количества органических соединений и материалов: альдегидов, кетонов, растворителей (тетрагалогенэтанов), исходных веществ для получения синтетических каучуков, поливинилхлорида и других поли-меров.
Наиболее широко используется ацетилен, который используется для синтеза уксусного альдегида, хлорвинила, используемого для получения полихлорвинила (ПВХ), винилацетата и поливинилацетата, составляющего основу клея ПВА, хлорпрена и синтетического хлорпренового каучука и др. Ацетилен сгорает в кислороде с выделением большого количества теплоты, температура пламени при этом достигает , что обусловливает это использование при сварке (кислородно-ацетиленовая сварка) и резке металлов.


0 Комментариев