АМИНОКИСЛОТЫ (АМК или Ак)
Аминокислоты представляют собой мономеры белков, которые являются биологическими полимерами. В них аминокарбоновые кислоты соединяются пептидными связями. Известны некоторые непериодические полимеры, в состав которых входит всего 3−8 АМК, но практически в каждом органическом соединении содержится примерно до 500 элементов.
Структура аминокислот.
Основными элементами, из которых состоит АМК, являются: углерод, водород, кислород, азот. Существуют некоторые соединения, в формулу которых входят и другие химические компоненты. В структуру мономеров одновременно входят: карбоксильные группы—COOH и аминогруппы—NН₂.

Из имеющихся 500 видов АМК, встречающихся в природе, существует 20 типов аминокислот, которые являются мономерами белка. Простейшее строение молекулы аминокислоты получается в результате соединения карбоксила и аминогруппы с атомом углерода и радикалом водорода. От девятнадцати мономеров белка строением отличается аминокислота пролин, в которой углерод связан как с водородом, так и с аминогруппой, поэтому молекула имеет циклическую форму. Остальные аминокислоты обладают асимметричным атомом углерода, с которым соединены четыре разные группы, замещающие друг друга.
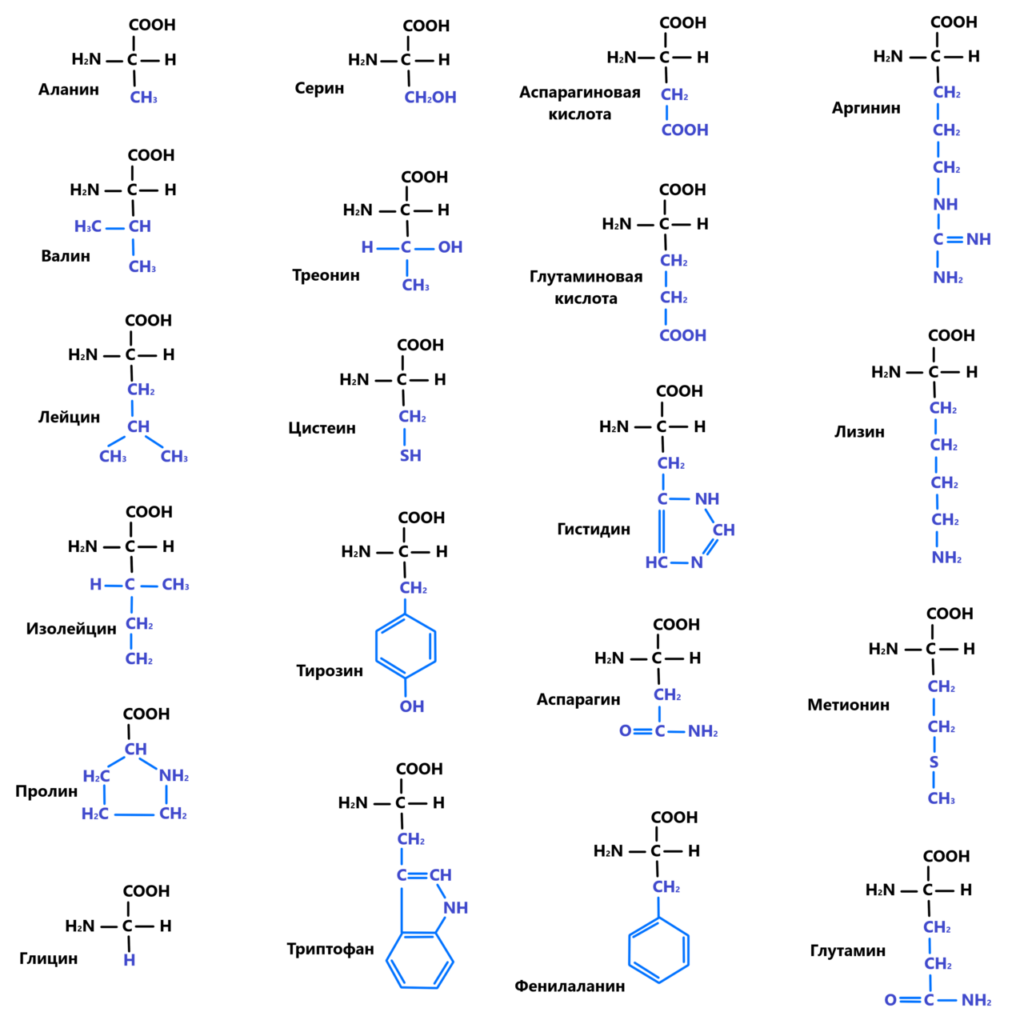
В природе существуют две формы изомерных соединений L и D. Исключением считается глицин, структурная конфигурация которого отличается отсутствием α-углерода, а в качестве радикала присутствует только водород. В течение длительного времени чистые L- и D-изомеры могут преобразовываться друг в друга. Этот процесс носит название рацемизации. При конкретной температуре в присутст-вии катализатора превращение любой L-аминокислоты протекает с определенной скоростью. Это свойство используется для опреде-ления возраста людей и животных. Например, в эмали зубов находится белковое вещество дентин, в котором со скоростью 0,01% L-аспартат переходит в D-изомер. Когда зубы начинают только формироваться, то в эмали присутствует только L-аминокислота, поэтому через некоторое время, посчитав процент D-изомеров, можно узнать возраст человека. Все 20 видов АМК, которые являются моно-мерами в биологических полимерах белках, различаются по структуре, размерам и химическим свойствам радикалов, связанных с атомом углерода. В отличие от растений, где синтезируются все типы аминокислот, в организме человека и животных насчитывается всего два вида. К ним относятся:
- Заменимые аминокислоты — поддаются синтезированию.
- Незаменимые — синтезу не подвергаются.

Второй тип АМК попадает в организм человека вместе с пищей. Кроме того, белки могут быть полноценными и неполноценными, в зависимости от состава мономеров. В первом виде органических соединений наблюдается полный комплект аминокислот, а во втором — некоторые компоненты отсутствуют. Простые биологические полимеры состоят только из АМК, а в сложных еще присутствует прос-тетическая группа, которая не относится к аминокислотам. В такую группу могут входить:
- металлопротеины,
- гликопротеины,
- липопротеины,
- нуклеотиды.
Классификация аминокислот:
В зависимости от количества аминогрупп и карбоксилов, аминокислоты бывают:
- Нейтральными, имеющими по одной амино- и карбоксильной группе.
- Основными, в состав которых входит несколько аминогрупп.
- Кислыми, которые обладают несколькими карбоксильными группами.
По химической структуре радикалов АМК делятся на четыре класса :
- неполярные;
- полярные;
- отрицательно заряженные;
- положительно заряженные.
Неполярные аминокислоты разделяются на:
- алифатические (аланин, лейцин, валин),
- ароматические (фенилаланин, триптофан),
- серосодержащие (метионин).
К полярным АМК относятся:
- оксиаминокислоты (серин, треонин),
- амидная группа (глутамин, аспарагин),
- глицин.
К отрицательно заряженным соединениям относятся кислоты:
- аспарагиновая,
- глутаминовая.
К положительно заряженным органическим соединениям относятся:
- лизин,
- гистидин,
- аргинин.
Аминокислоты относятся к гетерофункциональным соединениям, т.е. вещества, проявляющим свойства двух классов соединений. В неорганической химии такие соединения называют амфотерными.
Физические свойства аминокислот.
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений.
Способы получения.
Важнейшими способами получения аминокислот являются: 1. Аммонолиз а-галогенкарбоновых кислот

2. Получение из непредельных кислот

При взаимодействии α,β-ненасыщенных кислот с аммиаком образуются β-аминокислоты;
3. Гидролиз белков: Белок + Н2О → смесь аминокислот

Для лучшего усвоения изучаемого материалда посмотрите видео-урок , перейдя по ссылке: https://yandex.ru/video/preview/457424475921101026
Химические свойства аминокислот.
Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух проти-воположных по свойствам функциональных групп: кислотной и основной. α-аминокислоты являются амфотерными электролитами. Имея как минимум две диссоциирующие и противоположно заряженные группировки, аминокислоты в растворах с нейтральным значением рН практически всегда находятся в виде биполярных ионов, в которых противоположные заряды пространственно разде-лены, например +H3N—CH2—CH2—COO−. Амфотерность аминокислот обуславливает их характерные свойства.
1. Кислотные свойства аминокислот проявляются по карбоксильной группе в их способности взаимодействовать, например, с щелочами:

или вступать в реакцию этерификации со спиртами с образованием сложных эфиров:

2. Основные свойства аминокислот проявляются по аминогруппе в их способности взаимодействовать с кислотами, образуя комплексные ионы по донорно-акцепторному механизму:

3. Амфотерность аминокислот проявляется также в их способности образовывать в растворе в результате диссоциации биполярный ион — внутреннюю соль, а самое главное, за счет амфотерности аминокислоты могут вступать друг с другом в реакции поликонденсации. образуя полипептиды и белки:


Для лучшего усвоения изучаемого материалда посмотрите видео-урок , перейдя по ссылке:https://yandex.ru/video/preview/11064571068883693526
Для закрепления изученного материала перейдите по ссылке: https://learningapps.org/watch?v=pjq26k16t23 и выпол-ните задания.
Значение АМК для человека.
Исследования показали, что аминокислоты играют важную роль в работе мозга и нервной системы человека. Их малое количество в клетках центральной нервной системы приводит к депрессивному состоянию, бессоннице и усталости. Для предотвращения такой патологии особенно подходят: глицин; триптофан; треанин. Глицин в основном поступает в организм с пищей, но частично может синтезироваться в организме. Он считается важным элементом для клеток головного мозга, так как улучшает обмен веществ и укреп-ляет стенки кровеносных сосудов. Нехватка этого вида АМК приводит к эмоциональному напряжению и повышает артериальное давление. На нервную систему благотворно влияет триптофан, который в организме трансформируется в серотонин — «гормон ра-дости». Но особый интерес представляет танин, так как между ним и предыдущими видами есть некоторые отличия. Кроме того, что этот мономер активизирует работу головного мозга, он не оказывает никакого отрицательного влияния на нервную систему. Серосо-держащий метионин принимает участие в выработке холина, адреналина и креатина. Он способствует формированию фосфолипидов, которые являются основными компонентами клеточных оболочек печени. Органическое соединение карнитин держит отвечает за общую работоспособность всего организма, особенно у людей пенсионного возраста. Во время интенсивных занятий спортом он обес-печивает снижение веса за счет уменьшения содержания жиров в мышечных тканях. Карнитин обеспечивает органы тела энергией, значительно повышая выносливость организма к физическим нагрузкам. Появление любого заболевания указывает на то, что в орга-низме нарушен дисбаланс аминокислот.
Смеси аминокислот, а также индивидуальные аминокислоты применяют в медицине для парэнтерального питания больных с забо-леваниями пищеварительных и других органов, при нарушениях обмена веществ и др.
γ-Аминомасляная кислота (ГАМК) под названием аминалон применяется как лекарственное средство при лечении психиат-рических заболеваний; является медиатором в центральной нервной системе, влияет на процессы мышления.
Ароматические аминокислоты используют в синтезе таких известных лекарственных средств, как анестезин, новокаин и др.


0 Комментариев