Введение.
Оглавление
- 1 Введение.
- 2 Простейшие понятия: вещество, молекула, атом, химический элемент.
- 3 Первоначальные сведения о строении атома.
- 4 Строение молекулы химических веществ. Химические формулы. Молекулярные массы.
- 5 Простые и сложные вещества. Химические соединения и смеси.
- 6 Валентность элементов. Вывод химических формул. Графические формулы веществ.
- 7 Моль. Молярная масса.
- 8 Молярный объём и относительные плотности газов. Закон Авогадро. Уравнение Менделеева-Клапейрона.
- 9 Закон сохранения массы веществ. Уравнения химических реакций.
- 10 Расчёты по химическим формулам и уравнениям химических реакций.
Химия, наука привлекающая как взрослых, так и детей. Это загадочная наука. Именно поэтому в древние времена к людям, занимающимся изучением химических явлений, относились со страхом. Применение химических процессов было реализовано в глубокой древности: сплавление металлов, окраска тканей и т.д. Алхимия — средневековая наука, предшествующая химии. Алхимия, возникла в II–VI веке н. э. в Египте, в результате изучения свойств веществ. Её задачей было найти средство для продления молодости и найти способы превращения неблагородных металлов в золото и серебро. изучением металлов, их превращением в драгоценные металлы. И хотя многие считают алхимию «псевдонаукой», но многие открытия в области химии были сделаны именно алхимиками. Именно они создали будущее многим химическим процессам. С давних времен и по сегодняшний день химия продолжает оказывать человеку разностороннюю помощь. Достаточно привести слова М.В.Ломоносова: «широко простирает химия руки свои в дела человеческие» и сразу осознаёшь практическую роль химии в нашей жизни.
Простейшие понятия: вещество, молекула, атом, химический элемент.
Химия — наука о веществах, их строении, свойствах и превращениях.
Сразу возникает вопрос: «Что такое вещество?»
Вещество- это то, из чего состоит физическое тело. (Например: Вода — вещество, капля воды — физическое тело, алюминий — вещество, алюминиевая ложка — физическое тело.)
Физическое тело — это любой объект живой и неживой природы, имеющий массу, форму и объём.(например: камень, песчинка, люди, растения, животные, а также любой изготовленный предмет — физические тела.)

Вещество- это устойчивая система частиц (атомов, ионов или молекул), обладающая определёнными физическими и химическими свойствами.
Обязательным признаком вещества является наличие массы. Световые лучи и электромагнитное поле не имеют массы и к веществам не относятся. В мире существует очень много различных веществ. Одни из них существуют в природе, а другие созданы искусственно. (Например: вода, железо, соль, крахмал — природ-ные вещества; ацетон, аспирин, полиэтилен — искусственные вещества.)
Наименьшей частицей любого вещества является молекула, обладающая его химическими свойствами. А вот уже молекула состоит из атомов. Понятие «молекула» было введено в химию в связи с необходимостью отличать молекулу как наименьшее количество вещества, вступающее в химические реакции, от атома как меньшего количества данного элемента, входящего в состав молекулы.
Можно сказать, что молекула – структурная единица вещества, состоящая из атомов. В отличие от атомов, они больше и тяжелее, и обладают огромным разнообразием.
Вещество, молекулы которого состоят из одного атома, называются атомарными, из большего количества – молекулярными. (Например: кислород, вода, поваренная соль (O2,H2O,NaCl) – молекулярные; гелий серебро (He, Ag) – атомарные.)
Молекулы могут состоять как из атомов одного вида, так и из атомов разных видов и в связи с этим все вещества подразделяются на простые и сложные.
Простые вещества — это вещества, молекулы которых состоят из атомов одного элемента.
Сложные вещества — это вещества, молекулы которых состоят из атомов разных элементов.
Материалы – это вещества, используемые для изготовления предметов, оборудования, в строительстве и других отраслях.
Выше было отмечено, что вещества обладают физическими и химическими свойствами.
К физическим свойствам вещества относятся:
- агрегатное состояние,
- плотность,
- растворимость,
- температура плавления,
- температура кипения,
- цвет,
- вкус,
- запах и др.
Существуют три агрегатных состояния веществ: твердое, жидкое и газообразное. Любое вещество при изменении условий внешней среды может переходить из одного агрегатного состояния в другое. Изменение агрегатного состояния вещества – это физическое явление. (например: жидкая вода при 100°С превращается в пар, а при 0°С – в лёд.)
Физическое явление — это изменение формы или агрегатного состояния вещества, в результате которого не образуется новое вещество.
Химические свойства вещества — это способность вещества превращаться в другое вещество.
Химические явления, или химические реакции — превращения одних веществ в другие.В результате химической реакции изменяется состав или строение молекул, образующих данное вещество. Изменились молекулы — изменилось вещество — изменились его свойства: свежее молоко стало кислым; зелёные листья стали жёлтыми; сырое мясо при обжаривании изменило запах.
При этом исследуются не всякие превращения, а только такие, при которых
- изменяется состав или строение молекул;
- не изменяется состав и заряд ядер атомов.
Характерные признаки химических реакций:
| Изменение цвета | FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl желтый бесцв. красный |
| Образование осадка | ВаСl2 + H2SО4 = BaSО4↓ + 2H2O осадок |
| Выделение газа | Na2CО3 + 2НСl = 2NaCl + H2О + СО2 ↑ газ |
| Выделение теплоты | H2SО4 + 2NaOH = Na2SО4 + 2Н2О + Q теплота |
| Выделение света | 2Mg + О2 = 2MgO + hυ свет |
Первоначальные сведения о строении атома.
Атомы — мельчайшие частицы, из которых образованы молекулы всех веществ. Атомы имеют, сложное строение. В центре любого атома находится ядро. Ядро атома состоит из протонов и нейтронов. Протоны + нейтроны = нуклоны. (от англ. nucleus — ядро).

- Протон — это частица, которая имеет положительный заряд. Заряд протона в условных единицах равен +1. Символ протона — р.
- Нейтрон— нейтральная частица, заряд нейтрона равен 0. Символ нейтрона — n.
- Ядра атомов имеют положительный заряд, так как состоят из протонов с положительным зарядом и нейтральных нейтронов.
- Электроны движутся вокруг ядра, имеют отрицательный заряд. Заряд электрона в условных единицах равен -1. Символ электрона — ē.
Протоны + нейтроны + электроны = элементарные частицы.
Атомы являются электронейтральными частицами (иными словами: заряд атома равен нулю), т.к. в любом атоме содержится равное число протонов и электронов, поэтому сумма положительных зарядов в атоме равна сумме отрицательных зарядов.
Главной характеристикой любого атома является заряд ядра, который обозначается буквой Z и равен числу протонов: Z = ∑p
В течение любой химических реакций число электронов любого атома может изменяться, но заряд ядра атома в химических реакциях НЕ МЕНЯЕТСЯ! Именно поэтому заряд ядра атома — своеобразный «паспорт» химического элемента. Все атомы с зарядом ядра +1 принадлежат химическому элементу под названием «водород». Атомы с зарядом ядра +8 составляют химический элемент «кислород».
Поэтому каждому химическому элементу присвоен химический символ (знак), порядковый номер в таблице Менделеева; определённое название и особое прочтение символа в химической формуле.
Названия и символы наиболее важных химических элементов.
| Русское название элемента | Латинское название элемента | Символ элемента | Произношение символа | Русское название элемента | Латинское название элемента | Символ элемента | Произношение символа |
| Азот | Nitrogenium | N | эн | Неон | Neon | Ne | неон |
| Алюминий | Aluminium | Al | алюминий | Олово | Stannum | Sn | станнум |
| Аргон | Argon | Ar | аргон | Платина | Platinum | Pt | платина |
| Барий | Barium | Ba | барий | Ртуть | Hydrargirum | Hg | гидраргирум |
| Бром | Bromum | Br | бром | Свинец | Plumbum | Pb | плюмбум |
| Водород | Hydrogenium | H | аш | Сера | Sulfur | S | эс |
| Гелий | Helium | He | гелий | Серебра | Argentum | Ag | аргентум |
| Железо | Ferrum | Fe | феррум | Стронций | Strontium | Sr | стронций |
| Золото | Aurum | Au | аурум | Титан | Titanium | Ti | титан |
| Йод | Iodum | I | йод | Углерод | Carboneum | С | це |
| Калий | Kalium | К | калий | Фосфор | Phosphorus | P | пэ |
| Кальций | Calcium | Ca | Кальций | Фтор | Fluorum | F | фтор |
| Кислород | Oxygenium | 0 | 0 | Хлор | Chlorum | Cl | хлор |
| Кремний | Silicium | Si | силициум | Хром | Chromium | Cr | хром |
| Литий | Lithium | Li | литий | Цинк | Zincum | Zn | цинк |
| Магний | Magnesium | Mg | магний | Медь | Cuprum | Cu | купрум |
| Марганец | Manganum | Mn | марганец | Натрий | Natrium | Na | натрии |
Атомы имеют форму шара, и поэтому их размеры характеризуются диаметром или радиусом. Самый маленький атом — это атом водорода, его диаметр приблизительно равен 1∙10-8 см, или 1∙10-10 м. Диаметр атома хлора равен 1,8 • 10-8 см и т. д. Для выражения таких малых величин в химии используются единицы длины, которые называются ангстремами(А) и нанометрами (нм): 1Å= 10-10м; 1нм=1∙ 10-9м
В этих единицах диаметр атома водорода приблизительно равен 1Å или 0,1 нм.
Абсолютная атомная масса – это масса атома, выраженная в обычных единицах массы (кг или г), обозначается символом mа.
Атомная единица массы (а. е. м.) — это 1/12 часть абсолютной массы атома углерода.
Относительная атомная масса элемента — это число, которое показывает, во сколько раз абсолютная масса атома данного элемента больше 1/12 части абсолютной массы атома углерода, т. е. атомной единицы массы и обозначается символом Аr, (индекс «r» — первая буква английского слова «relative» — относительный).
Вопросы для самопроверки.
- Как называются частицы, которыми образованы все вещества?
- Что находится в центре атома?
- Из чего состоит ядро атома?
- Какое общее название имеют протоны и нейтроны?
- Чему равен заряд протона в условных единицах?
- Какой заряд имеют ядра атомов? Почему?
- Как называются частицы, которые движутся вокруг ядра атома?
- Чему равен заряд электрона в условных единицах?
- Какое общее название имеют протоны, нейтроны и электроны?
- Почему атомы являются электронейтральными частицами?
- Что является главной характеристикой любого атома?
- Чему равен заряд ядра атома?
- Что называется химическим элементом?
Строение молекулы химических веществ. Химические формулы. Молекулярные массы.

Вам уже известно, что молекулы это структурные единицы вещества, образующиеся в результате соединения атомов друг с другом при помощи химических связей. Состав молекулы любого вещества выражается химической (молекулярной или эмпирической) форму-лой, которая отражает качественный (из атомов каких элементов состоит молекула) и количественный (сколько атомов данного вида в молекуле) состав чистого вещества. Каждое чистое вещество имеет постоянный качественный и количественный состав, независимо каким способом это вещество было получено.
| Химическая формула: | Н2О | Na2CO3 | Al2(SO4)3 |
| Название вещества: | вода | карбонат натрия | сульфат алюминия |
| Произношение формул: | аш-два-о | натрий-два-цэ-о-три | алюминий-два-эс-о-четыре-трижды |
| Качественная характеристи-ка | В состав молекулы данного вещества входят атомы 2-х видов: водорода и кислорода. | В состав молекулы данного вещества входят атомы 3-х видов: натрия, углерода и кислорода. | В состав молекулы данного вещества входят атомы 3-х видов: алюминия, серы и кислорода. |
| Количественная характерис-тика: | Одна молекула данного вещества состоит из 3 атомов: 2-х атомов водорода и 1 атома кис-лорода. | Одна молекула данного вещества состоит из 6 атомов: 2-х атомов натрия, 1 атома углерода и 3 атомов кислорода. | Одна молекула данного вещества состоит из: 17 ато-мов: 2-х атомов алюминия,3-х атомов серы и 12 атомов кис-лорода. |
| Индексы: | 2,1 | 2,1,3 | 2,1,4,3 |
На количество атомов каждого вида в молекуле вещества указывает цифра, стоящая внизу справа от символа элемента — индекс. Индекс «1» НИКОГДА в формуле не пишется.

Вещества атомарного строения характеризуются величиной относительной атомной массы, которая обозначается Аr , а вещества, имеющие молекулярное строения характеризуются величиной относительной молекулярной массы, кото-рая обозначается Mr. Величина Аr указана в периодической таблице Д.И.Менделеева. Масса молекулы любого вещества равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы элементов Аr , то получается относительная молекулярная масса, которая обозначается символом Мr, и равна сумме относительных атомных масс элементов, входящих в состав молекулы данного вещества.

Относительная молекулярная масса вещества Мr — это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода С. Например: Относительная молекулярная масса воды Мr (H2O) равна сумме (∑ — знак суммы) относительных атомных масс водорода и кислорода т.е. Мr (H2O)=Аr (H) +Аr (Н) +Аr (O) т.к. в состав молекулы воды входит 2 атома водорода и один атом кислорода, чтобы упростить эту запись нужно Аr (Н) умножить на 2, т.е. перед Аr (Н) поставить коэффициент 2. Тогда запись будет выг-лядеть таким образом: Мr (H2O)= 2Аr (H) + Аr (O). Теперь можно подставить числовые значения: Мr (H2O)= 2 ×1+ 16 = 18 . Относительные атомные массы элементов берем из периодической таблицы (Аr (Н) =1, Аr (O)=16). Относительные молекулярные массы и относительные атомные массы, являются величинами безразмерными. Значение Мr показывает, во сколько раз масса молекулы данного вещества больше атомной единицы массы, т.е. если Mr(H2O) = 18, это значит, что масса молекулы H2O в 18 раз больше 1/12 части массы атома углерода.
Химические формулы показывают качественный и количественный состав молекулы.
Закон постоянства состава вещества, предложенный (Ж. Прустом в 1808 г. гласит, что каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.
Массовая доля (ω) атомов химического элемента в веществе показывает, какая часть относительной молекулярной массы вещества приходится на атомы данного элемента. По формуле вещества можно рассчитать массовую долю атомов каждого химического элемен-та, который входит в состав этого вещества, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента. Массовая доля (ω) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число этих атомов в молекуле, к относительной молекулярной массе вещества:

где ω(Х)(«дубль-вэ») — массовая доля элемента X; Аr (Х) — относительная атомная масса элемента X; п — число атомов элемента X в молекуле вещества; Мг — относительная молекулярная масса вещества. Массовые доли обычно выражают в процентах. Как определить массовые доли элементов входящих в состав какого-либо вещества? Давайте рассмотрим пример:

Вопросы для самопроверки.
- Какие частицы обычно образуются в результате соединения атомов?
- Чем можно выразить состав любой молекулы?
- Что называется индексами в химических формулах?
- Что показывают химические формулы?
- Как формулируется закон постоянства состава?
- Что такое молекула?
- Чему равна масса молекулы?
- Что такое относительная молекулярная масса?
- Чему равна массовая доля данного элемента в данном веществе?
- Что такое относительная атомная масса химического элемента?
- Каким символом она обозначается?
- Что называется абсолютной атомной массой?
- Какие атомные массы обычно используют в химии?
- Что принимают за единицу атомных масс?
Выполните самостоятельно.
- Опишите качественный и количественный состав молекул следующих веществ: метан СН4, сода Na2CО3, глюкоза С6Н12О6, хлор С12, сульфат алюминия Al2(SО4)3.
- Молекула фосгена состоит из одного атома углерода, одного атома кислорода и двух атомов хлора. Молекула мочевины состоит из одного атома углерода, одного атома кислорода и двух атомных групп NH2. Напишите формулы фосгена и мочевины.
- Подсчитайте общее число атомов в следующих молекулах: (NH4)3PО4, Ca(H2PО4)2, [Fe(OH)2]2SО4.
- Рассчитайте относительные молекулярные массы веществ, которые указаны в упражнении1.
- Чему равны массовые доли элементов в следующих веществах: NH3, N2О, NО2, NaNO3, KNО3, NH4NО3? В каком из этих веществ массовая доля азота наибольшая и в каком — наименьшая?
- Напишите, как произносятся следующие формулы: НСl, NaNO3, С6Н12О6, Mg(NO3)2, Fe2(SО4)3.
- Напишите формулы, которые имеют следующее произношение: а) «кальций-фтор-два», б) «це-двенадцать-аш-двадцать два-о-одиннадцать», в) «купрум-три-пэ-о-четыре-дважды», «аш-хлор-о-четыре».
- Диаметр атома хлора равен 1,8∙ 10-8 см. Выразите его в ангстремах и нанометрах.
- Сколько ангстремов и нанометров в: а) 1 м? б) 1 см?
- Используя относительные атомные массы элементов, рассчитайте, во сколько раз масса атома меди больше массы: а) атома серы; б) атома кислорода; в) атома водорода.
Простые и сложные вещества. Химические соединения и смеси.

Вы уже знаете, что такое вещество. В химии существует такое понятие, как чистое вещество — это вещество, состоящее из частиц только одного вещества. Абсолютно чистые вещества получить невозможно, поэтому чистыми веществами условились называть такие вещества, в которых почти нет примесей. Примесь — это вещество, содержащееся в основном веществе в очень малом количестве. Вам также известно, что чистые вещества делятся на простые и сложные. Простые вещества — это вещества, которые состоят из атомов одного химического элемента. Примером таких веществ могут быть кислород (O2), аргон (Ar), азот (N2). Для простых веществ характерно такое явление, как аллотропия. Аллотропия — это явление образо-вания нескольких простых веществ одним элементом. Разные простые вещества, которые образуются одним и тем же химическим эле-ментом, называются аллотропными видоизменениями (модификациями) — кислород O2 и озон O3.

В природе чаще всего встречаются не чистые вещества, а смеси веществ. В практической деятельности также обычно используются смеси веществ. Любая смесь состоит из двух или большего числа веществ, которые называются компонентами. Смеси веществ бывают гомогенными (однородными) и гетерогенными (неоднородными). Вещества в смеси могут находиться в любых соотношениях. Гомогенные смеси — смеси, в которых между компонентами нет поверхности раздела. Гомогенными являются смеси газов (воздух), жидкие растворы(раствор сахара в воде). Гетерогенные смеси — это смеси, в которых компоненты разделяются поверхностью раздела. К гетерогенным относятся смеси твердых веществ (песок + порошок мела), смеси нерастворимых друг в друге жидкостей (вода + масло), смеси жидкостей и нерастворимых в нем твердых веществ (вода + мел).
Важнейшие отличия смесей от химических соединений:
- В смесях свойства отдельных веществ (компонентов) сохраняются.
- Состав смесей не является постоянным.
Вопросы для самопроверки.
1. Какие простые вещества имеют молекулярное строение (названия и формулы)? 2. Какие простые вещества имеют атомное строение? Приведете пример. 3. Что такое аллотропия? 4.Что называется аллотропными видоизменениями (модификациями)?
Валентность элементов. Вывод химических формул. Графические формулы веществ.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения? Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:

Основываясь на вышепредложенные формулы, можно отметить, что в молекуле хлороводорода атом хлора связан с одним атомом водорода, в молекуле воды атом кислорода связан с двумя атомами водорода, в молекуле аммиака атом азота связан с с тремя атомами водорода, а в молекуле метана атом углерода связан с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен. Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле хлороводо-рода HCl у атома хлора валентность равна единице т.к. он соединен с 1 атомом водорода, а в молекуле H2O у атома кислорода валент-ность равна двум т.к. атом кислорода соединен с двумя атомами водорода . По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, то всё вышесказанное можно изобразить схематически:
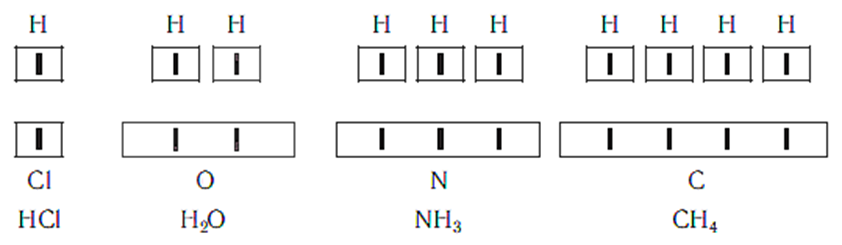
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении. Численные значения валентности обозначают римскими цифрами над символами хими-ческих элементов: I I I II I III I IV HCl H2O H3N H4C
Валентностью элемента называется число химических связей, которые образует один атом данного элемента в данной молекуле. Все элементы можно разделить на две группы: элементы с постоянной валентностью — это элементы, которые во всех соединениях про-являют одинаковую валентность и элементы, с переменной валентностью — это элементы, которые в разных соединениях могут иметь различные значения валентности.

Составление химических формул по валентности.
Зная валентность элементов, можно составлять формулы их бинарных соединений. При составлении химических формул бинарных соединений, следует придерживаться алгоритма:

Определение валентности элементов.
Для определения валентности элементов в каком-либо соединении используется правило валентности. Согласно этому правилу, в боль-шинтве бинарных соединений типа АmВn произведение валентности элемента А (х) на число его атомов (т) равно произведению валентности элемента В (у) на число его атомов (п): x∙m = y∙n Например: Определите валентность азота в его оксиде (N2O3). Исходя из формулы оксида
| 1 | Написать формулу соединения. | N2O3 |
| 2 | Составить соотношение согласно правила валентности, для этого число атомов азота — 2 умножаем на валентность азота — х и приравниваем к произведению числа атомов кислорода 3 на валентность кислорода II, т.к. кислород — эле- мент с постоянной валентностью. | 2×х = 3×2 |
| 3 | Перемножаем обе части. | 2х = 6 |
| 4 | Находим «х», для этого шесть делим на два. Получаем 3. Следовательно валентность азота равна трём. | х=6/2 х= 3 |
Вопросы для самопроверки.
- Что такое валентность элемента?
- Какими цифрами обычно обозначается валентность?
- Что такое элементы с постоянной валентностью?
- Какие элементы имеют постоянную валентность?
- Как формулируется правило валентности?
- Как называются формулы, которые показывают порядок соединения атомов в молекулах и валентность каждого элемента?
Выполните самостоятельно.
1. Определите валентность элементов в следующих соединениях: AsH3, CuO, N2О3, CaBr2, SFfi, K2S, Si02, Mg3N2. Составьте графические формулы этих веществ.
2. Определите индексы m и n в следующих формулах:HmSen, PmCIn, РЬmОn , OmFn, FemSn Напишите графические формулы этих веществ.
3. Составьте формулы соединений, молекулы которые состоят из: а) марганца (II) и кислорода; б) марганца (IV) и кислорода; в) марганца (VI) и кислорода; г) хлора (VII) .и кислорода; д) бария и кислорода. Напишите графические формулы этих веществ.
Графические формулы.
Для получения более полной информации о веществе пользуются графическими формулами, которые указывают порядок соединения атомов в молекуле и валентность каждого элемента. Графические формулы веществ, состоящих из молекул, отражают и строение (структуру) этих молекул, и в этом случае их можно назвать структурными. Для составления графической (структурной) формулы вещества необходимо:
- Определить валентность всех химических элементов, образующих вещество.
- Записать знаки всех химических элементов, образующих вещество, каждый в количестве, равном числу атомов данного элемента в молекуле.
- Соединить знаки химических элементов черточками. Каждая черточка обозначает электронную пару, осуществляющую связь между химическими элементами и поэтому одинаково принадлежит обоим элементам.
- Число черточек, окружающих знак химического элемента, должно соответствовать валентности этого химического элемента.
- При составлении формул кислородсодержащих кислот и их солей атомы водорода и атомы металлов связываются с кислотообразующим элементом через атом кислорода.
- Атомы кислорода соединяют друг с другом только при составлении формул пероксидов.

Для закрепления пройденного материала Вам необходимо перейти по ссылке здесь: https://learningapps.org/watch?v=pgmk14oi222
Моль. Молярная масса.
Если необходима какая-то порция твердого вещества, то для этого следует взять нужную его массу, т. е. взвесить вещество. Нужный объем жидкого вещества обычно отмеряют с помощью мензурки или мерного цилиндра. Для отбора необходимой порции (объема) газообраз-ных веществ применяют специальные емкости — газометры. Значит, объем и масса — это величины, характеризующие порцию вещества.
Химическое количество вещества.
Понятия «масса» и «количество» очень часто считают синонимами, но на самом деле это разные понятия. Если Вы покупаете товар в килограммах или граммах (1 кг сахара), то в этом случае речь идет о массе. Но если вы покупаете товар штучно (1 булка хлеба), то в этом случае речь идет о количестве. Массу любого вещества измеряют в граммах, килограммах, тоннах, а количество — в штуках. Крупные предметы посчитать легко, а как посчитать мелкие предметы (зерно), а молекулы? Поэтому такой товар (зерно) обычно продают меш-ками, т. е. определенными порциями. В каждой такой порции — мешке (если они равны по массе и все зерна одинаковы) — будет нахо-диться практически одно и то же число зерен. В химической практике, помимо массы или объема, необходимо знать число структурных единиц (атомов, молекул), которые содержатся в данной порции вещества, поскольку именно они участвуют в химических реакциях. Поэтому в химии используют физическую величину, характеризующую число частиц в рассматриваемой порции вещества. Эта физичес-кая величина называется количеством вещества или химическое количество вещества.
Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
Другими словами, химическое количество вещества — это порция данного вещества, содержащая определенное число его структурных единиц. Химическое количество вещества обозначают латинской буквой n. Это одна из семи основных физических величин Междуна-родной системы единиц (СИ).
Моль — единица химического количества вещества.
Каждая из основных физических величин имеет свою единицу. Например, единица длины — метр (м), единица массы — килограмм (кг), единица времени — секунда (с). Единицей химического количества вещества является моль.

Моль — порция вещества (т. е. такое его химическое количество), которая содержит столько же структурных единиц, сколько атомов содержится в углероде массой 0,012 кг.
Сокращенное обозначение единицы химического количества записывается — моль. Поэтому, если слово «моль» стоит после числа, то оно не склоняется: 3 моль, 5 моль, 8 моль. При чтении вслух и при записи числительного буквами слово «моль» склоняется: три моля, пять молей, восемь молей.
Чтобы узнать число (N) атомов в порции углерода массой 0,012 кг нужно знать массу одного атома углерода (19,94·10-27 кг):

Следовательно, в углероде массой 0,012 кг содержатся 6,02·1023 атомов углерода и эта порция составляет 1 моль. Столько же струк-турных единиц содержится в 1 моль любого вещества.
Величина, равная:

получила название постоянной Авогадро. Она является одной из важнейших универсальных постоянных и обозначается символом NA:

Единица в числителе дроби (1/моль) заменяет название структурной единицы. Если структурной единицей вещества (меди, углерода) является атом, то в порции этого вещества количеством 1 моль содержатся 6,02·1023атомов. В случае веществ молекулярного строения (вода, углекислый газ) их порции количеством 1 моль содержат по 6,02·1023молекул.
Зная химическое количество n данного вещества Х, легко рассчитать число молекул (атомов) N(Х) в этой порции: если 1 моль вещества содержит 6,02·1023 молекул, то n моль вещества содержат N(Х) молекул. Отсюда:
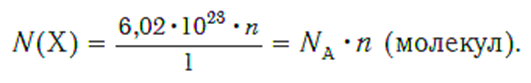
И также, по числу структурных единиц можно рассчитать химическое количество вещества:



Молярная масса.
Молярная масса — это масса порции вещества химическим количеством 1 моль. Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):

В Международной системе единиц (СИ) молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Пример 3: Определить молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
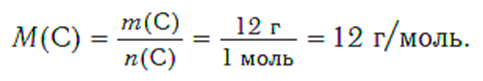
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:

Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
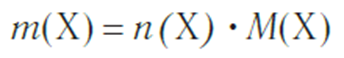
и, наоборот, химическое количество по массе:
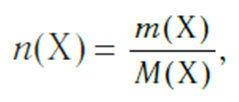
а также число структурных единиц:

Вопросы для самопроверки.
- Как называется масса 1 моля вещества и в каких единицах она выражается?
- В каких единицах выражается масса вещества?
- Что является единицей количества вещества?
- Что такое моль?
Выполните самостоятельно.
- Сколько молей атомов углерода, водорода и кислорода содержится в 1 моле глюкозы С6Н1206?
- Сколько молей атомов азота содержится в 16 г нитрата аммония NH4N03?
- Сколько молей составляют и сколько атомов содержат: а) 8г серы S; б) 280 г железа Fe; в) 3,2 кг меди Си?
- Определите массу: а) 0,1 моль Н2; б) 5 моль СО; в)1,5моль CuSО4; г) 2,5 моль Mg; д) 10-3 моль Н3РО4.
Молярный объём и относительные плотности газов. Закон Авогадро. Уравнение Менделеева-Клапейрона.
Молярный объем.
Все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm. Молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):

Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нор-мальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С или 273К и давление 1 атм. или 760мм.рт.ст., или 101 325 Па, или101,325 кПа.
При нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль или л/моль. Другими словами, молярный объем любого газа при нормальных условиях:

Молярный объем — это объем, равный 22,4 л, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?

Пример 2. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?

Закон Авогадро.
Закон Авогадро — В равных объемах (V) различных газов при одинаковых внешних условиях (температуре Т и давлении Р) содержится одинаковое число молекул (N).

Первое следствие из закона Авогадро — Одинаковое число молекул различных газов при одинаковых условиях занимает одинаковый объем:

Объем одного моля любого газа (т.е. 6,02 • 1023 молекул) при определенных внешних условиях есть величина постоянная.
Второе следствие из закона Авогадро используется для расчета относительных плотностей газов.
Относительная плотность газа.
Плотность любого вещества ρ — это отношение массы этого вещества т к его объему V. Для обозначения плотности обычно исполь-зуется греческая буква ƿ (ро), иногда используются латинские буквы D и d (от лат.densitas «плотность»). Исходя из определения плот-ности, её размерность представляет собой кг/м³ в СИ и г/см³ в системе СГС.

Относительная плотность газа X по газу Y обозначается DY(X) -это отношение плотностей этих газов ρ(X)/ ρ(Y):

Относительная плотность одного газа по другому газу равна отношению их молярных или относительных молекулярных масс (так как М и Мг численно равны):

Относительная плотность любого газа X по водороду равна:

Воздух — это смесь газов, средняя относительная молекулярная масса воздуха равна 29. Относительная плотность любого газа Х по воздуху равна:

Молекулярные (молярные) массы неизвестных газов можно определять по относительным плотностям этих газов по водороду или по воздуху:

Уравнение Менделеева-Клапейрона.
Уравнение объединенного газового закона или уравнение Клапейрона используют в расчётах, связанных с газами, когда требуется перейти от данных условий к нормальным, или наоборот:

где Р — давление, V — объем, Т — абсолютная температура; индекс «н» указывает на нормальные условия.
Уравнение Клапейрона—Менделеева (уравнение состояния идеального газа): отражает соотношение между давлением газа Р, его объемом V, количеством вещества (газа) n и температурой Т :

где т — масса газа, М — его молярная масса, R — универсальная газовая постоянная.
Вопросы для самопроверки.
- Как обозначается и чему равно число Авогадро?
- Чем определяется объем газа — размером его молекул или расстояниями между ними?
- Как формулируется закон Авогадро?
- Как формулируется первое следствие из закона Авогадро?
- Что называется молярным объемом?
- Чему равны нормальная температура и нормальное давление?
- Чему равен молярный объем любого газа при нормальных условиях?
- Каким уравнением выражается объединенный газовый закон?
- Каким уравнением выражается соотношение между количеством, объемом, температурой и давлением газа?
- Чему равна объемная доля данного газа в смеси с другими газами?
Выполните самостоятельно.
- Какой объем при нормальных условиях занимают: а) 20 г аргона Аг; б) 7,1 г хлора Сl2; в) 40 г метана СН4; г) 0,85 г аммиака NH3; д) 1,4 кг азота N2?
- Чему равна масса: а) 1 л водорода Н2; б) 1 л кислорода 02; в) 1 м3 углекислого газа С02? (Объемы газов даны при нормальных условиях.)
- 10 г некоторого газа при н.у. занимают объем 5,6 л. Определите молярную и относительную молекулярную массу этого газа.
- Определите молярную массу газа, относительная плотность которого: а) по водороду равна 32; б) по воздуху равна 2,45; в) по аргону Аr равна 0,43.
- Определите объем, который занимают 0,07 кг азота N2 при 21°С и давлении 142 кПа.
Для закрепления пройденного материала Вам необходимо перейти по ссылке здесь https://learningapps.org/watch?v=puhrwouq222 и выполнить все работы.
Закон сохранения массы веществ. Уравнения химических реакций.
Закон сохранения массы веществ.
Закон сохранения массы веществ в химических реакциях был сформирован на основе работ М. В. Ломоносова и А. Лавуазье. Суть этого закона заключается в следующем: «Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.»
При химических реакциях атомы не исчезают бесследно и не возникают из ничего. Их число остается неизменным. А так как они имеют постоянную массу, то и масса образованных ими веществ также остается постоянной. Закон важен для правильного понимания всего совершающегося в природе: ничто не может исчезнуть бесследно и возникнуть из ничего.
Химические уравнения.
Химические реакции можно изобразить, используя химические формулы. Химические элементы обозначают химическими символами, состав веществ записывают при помощи химических формул, химические реакции выражают при помощи химических уравнений, т. е. так же, как из букв составляются слова, из слов — предложения.
Уравнение химической реакции (химическое уравнение) — это условная запись реакции при помощи химических формул и знаков «+» и «=».
Закон сохранения массы веществ в химических реакциях должен соблюдаться и при составлении уравнений химических реакций. Как и в математических уравнениях, в уравнениях химических реакций имеется левая часть (где записываются формулы исходных веществ) и правая часть (где записываются формулы продуктов реакции):

вещества реакции
При написании уравнений химических реакций знак «+» соединяет формулы веществ в левой и правой частях уравнения. Так как масса веществ до реакции равна массе образовавшихся веществ, используется знак «=», который связывает левую и правую части уравнения. Для уравнивания числа атомов в левой и правой частях уравнения используются числа перед формулами веществ. Эти числа называются коэф-фициентами химических уравнений и показывают число молекул или формульных единиц. Поскольку 1 моль любого вещества состоит из одинакового числа структурных единиц (6,02×1023), то коэффициенты показывают и химические количества каждого из веществ:
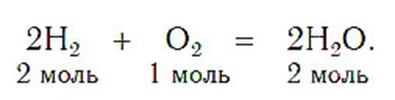
Химическое уравнение — это выражение химической реакции, в котором записаны формулы исходных веществ (реагентов) и продуктов реакции.
Коэффициент – это число, стоящее перед формулами веществ в уравнении реакции.
При написании химических уравнений применяют также и специальные знаки, например знак «↓», обозначающий, что вещество образует осадок:реакции, а также коэффициенты, показывающие число молекул каждого вещества.

знак «↑», обозначающий, что вещество выделяется в виде газа .

Часто в уравнениях химических реакций над знаком «=» указывают условия их протекания: нагревание (t), облучение светом (hν), электри-ческий ток (↯) и др.
Составление уравнений реакций.
При составлении химических уравнений и произведении расчетов по ним необходимо опираться на закон сохранения массы веществ. Рассмотрим, как можно составить химическое уравнение (алгоритм составления уравнений), на примере реакции водорода с кислородом.
- Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку: водород + кислород → соединение водорода с кислородом. Такую запись называют схемой химической реакции.
- Теперь в схеме все слова заменим символами и запишем эту схему при помощи химических формул: H2 + O2 → HO В реакцию вступают простые вещества водород и кислород, Вам уже известно, что это газообразные вещества и их молекулы двухатомные, поэтому формулы этих веществ будут выглядеть следующим образом: водород —H2 , а кислород — O2 . Продуктом реакции является соединение водорода с кислородом. Необходимо правильно составить формулу этого соединения: В схеме мы написали формулу соединения НО (на первом месте в формуле пишем водород, т.к. он находится в 1 группе периодической таблицы и у него на внешнем электронном слое всего 1 электрон, о кислород находится в шестой группе периодической таблицы и у него на последнем электронном слое 6 электронов. Кислород считается наиболее электроотрицательным элементом, чем водород, поэтому в формуле соединения он будет стоять на 2 месте.).
- Водород и кислород относятся к элементам с постоянной валентностью: валентность водорода — I, валентность кислорода — II, нахо-дим НОК (наименьшее общее кратное) между 1 и 2, это будет число 2. находим индекс для водорода: НОК (2) делим на валентность водорода (1) получаем 2 (индекс), точно также находим индекс для кислорода 2:2=1.
- Теперь расставляем индексы справа внизу у каждого символа:справа от водорода мы ставим индекс 2, а индекс 1 в формулы не ставится. Следовательно наша схема будет выглядеть так: H2 + O2 → H2O
- Следующим этапом в составлении уравнения реакции будет преобразование схемы химической реакции в уравнение химической реакцию Для этого нужно расставить коэффициенты:
- Число атомов водорода в левой части схемы равно двум и в правой тоже двум.
- Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой H2O ставим коэффици-ент 2: H2 + O2 → 2H2O
- Теперь число атомов водорода после реакции (в правой части схемы) равно четырём, а до реакции (в левой части схемы) — двум, поэтому перед формулой водорода H2 поставим коэффициент 2 (2H2).
- В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам право заменить стрелку на знак «=»: 2H2 + O2 = 2H2O. Схема превратилась в уравнение химической реакции. Это уравнение читается: два аш-два плюс о-два равно два аш-два-о
Давайте рассмотрим ещё один вариантна примере реакции между хлоридом кальция CaCl2 и фосфатом натрия Na3PO4. При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп (PO4 ), то можно учитывать число этих групп, считая их единым целым
- Составляем схему реакции: CaCl2 + Na3PO4 → NaCl + Ca(PO4 ) II I I III
- Определяем валентность исходных атомов и группы PO4: CaCl2 + Na3PO4 → (кальций — элемент с постоянной валентностью =II, хлор — элемент с переменной валентностью и в хлориде кальция хлор проявляет валентность=I, т.к. на две валентности кальция приходится два атома хлора.
- Перенесём эти числа в правую часть уравнения: II I I III I I II III CaCl2 + Na3PO4 → NaCl + Ca(PO4 )
- Составляем химические формулы полученных веществ по валентностям составных частей: CaCl2 + Na3PO4 → NaCl + Ca3(PO4 )2 (у натрия и хлора валентности равны, поэтому делаем вывод, что формула хлорида натрия — NaCl — составлена правильно, переходим ко второму продукту реакции — фосфату кальция. В данном соединении кальций двухвалентен, а фосфат-ион — трёхвалентен, т.к. он является кислотным остатком трёхосновной фосфорной кислоты (в молекуле кислоты Н3PO4 кислотный остаток —PO4 соединен с тремя атомами водорода). Находим НОК для 2 и 3, это число 6, делим 6 на валентность кальция 2 и получаем индекс 3, а дальше мы определяем индекс для кислотного остатка: 6:3=2.)
- Обращаем внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три), поэтому перед формулой CaCl2 поставим коэффициент 3, и число групп РО4 (их две), поэтому перед формулой Na3PO4 поставим коэффициент 2: 3CaCl2 + 2Na3PO4 → NaCl + Ca3(PO4 )2 Количество атомов кальция и число кислотных остатков мы уравняли.
- Осталось уравнять число атомов натрия и хлора. Исходя из схемы реакции, можно сделать вывод, что в реакцию вступило 6 атомов натрия, а получился только один, точно такое заключение можно сделать и в отношении хлора. Чтобы не нарушать закон сохранения массы веществ, нужно увеличить число атомов натрия и хлора в 6 раз, для этого поставим коэффициент 6 перед формулой NaCl. Число атомов натрия и хлора до реакции и после реакции стало равным шести. 3CaCl2 + 2Na3PO4 → 6NaCl + Ca3(PO4 )2
- Схема реакции превратилась в уравнение реакции, поэтому знак → можно заменить на =. 3CaCl2 + 2Na3PO4 = 6NaCl + Ca3(PO4 )2
Вопросы для самопроверки.
- Как называется закон, который открыли Ломоносов и Лавуазье?
- Как формулируется закон сохранения массы веществ?
- Чем объясняется сохранение массы веществ в химических реакциях?
- Что такое химическое уравнение?
- Как называются числа перед формулами веществ в химических уравнениях?
- Что показывают коэффициенты перед формулами веществ в уравнении химической реакции?
Выполните самостоятельно.
1. Сколько граммов сульфида серебра Ag2S можно получить по реакции: 2Ag+S = Ag2S, если имеется смесь 10 г серебра и 1 г серы? Какое вещество содержится в этой смеси в избытке?
2. Определите массу соли и объем водорода (н. у.), которые получаются при взаимодействии 1,5 моль алюминия с избытком серной кислоты по реакции, выражаемой следующей схемой: Al2О3 + H2SO4→Al2(SO4)3 +Н2↑.
3. Cоставьте уравнения реакций, которые выражаются следующими схемами:
а) Fe + Сl2 → FeCl3; г) С3Н7ОН + О2 → СО2 + Н2О;
б) Аl + S → Al2S3; д) Li3N + Н2О→ NH3 + LiOH;
в) N2О5 + H2О → HNО3; e) Fe(OH)3 + H2SО4 → Fe2(SО4)3 + Н2О
Расчёты по химическим формулам и уравнениям химических реакций.
В химии при решении задач пользуются единицами величин:

Для того чтобы выполнить расчёт по уравнению реакции, нужно внимательно прочитать условие задачи и:
- составить уравнение химической реакции, расставить коэффициенты;
- по коэффициентам уравнения химической реакции определить число молей реагирующих веществ;
- НАД формулами соединений указать данные задачи, отметив их размерность (г, л, моль);
- ПОД формулами этих соединений сделать расчёт таким образом, чтобы размерность величин «над» и «под» химическими формулами совпали;
- составить пропорцию из «верхних» данных и «нижних» результатов и выполнить расчёт
Особое внимание уделяется расстановке коэффициентов, чтобы всё соответствовало закону сохранения массы веществ.
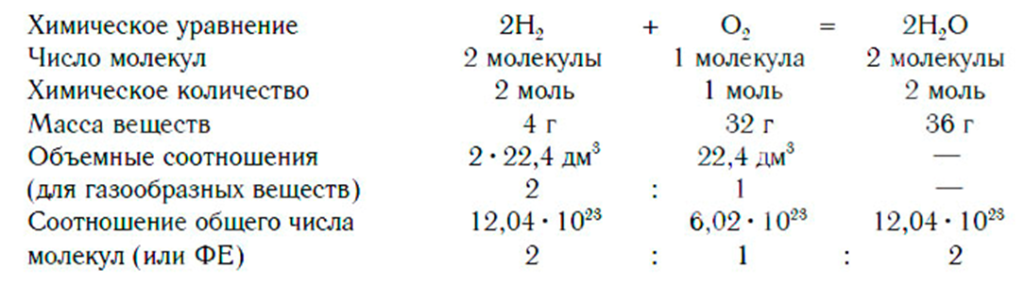





Расчеты массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси).
На практике обычно используют не стехиометрические количества веществ — один из реагентов берется в некотором избытке. Поскольку избыток реагента в реакции не участвует, то химические расчеты следует проводить по веществу, которое полностью вступает в реакцию (иногда говорят, что оно дано в недостатке). Кроме того, любые из веществ всегда содержат примеси. Массовая доля примесей вычисляется по формуле:

Пример 4. В раствор, содержащий 1,2 моль НCl опустили избыток алюминия. Какой объём водорода выделится при этом?
Решение. Составим уравнение реакции и запишем, что дано в ней, над формулами соединений. При этом обязательно указывай-те размерность.
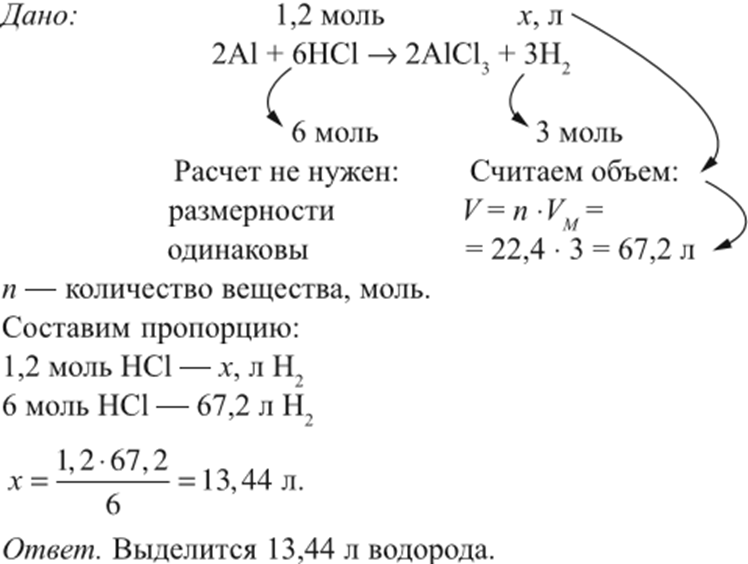
Пример 5. Сколько граммов алюминия нужно растворить в соляной кислоте, чтобы получить 5,6 л водорода?
Решение. Составим уравнение реакции и запишем, что дано в ней, над химическими формулами соединений.

Пример 6. Какой объём углекислого газа выделится при полном сгорании 6 л ацетилена С2Н2?
Решение.
В случае, когда нужно определить объёмы реагирующих газов, можно воспользоваться следствием из закона Авогадро: «Объёмы реа-гирующих газов относятся как их коэффициенты в уравнении химической реакции».

Пример 7. Смесь меди и алюминия массой 10 г обработали раствором щёлочи. При этом выделилось 10 л газа (н. у.). Определить состав смеси в масс.% (массовые доли алюминия и меди в смеси).
Решение. Составим уравнения реакций:


Составим пропорцию и определим массу алюминия в смеси:

отсюда:

Ответ. ώ(Al) = 80 %, ώ(Сu) = 20 %.
Пример 8. На нейтрализацию 20 г смеси гидрофосфата и дигидрофосфата натрия потребовалось 25 г 40 %-ного раствора NaOH. Определить состав смеси.
В задачах типа, когда в химическом превращении участвуют все компоненты смеси, в результате чего образуется смесь газов или других продуктов реакции, неизвестную величину принимают за известную, и обозначают А.
Составим уравнения реакций:
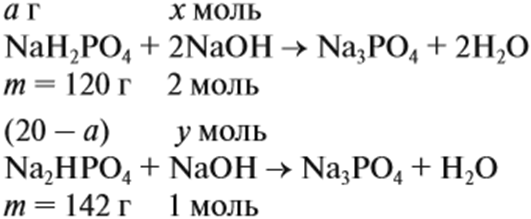
Определим количество вещества NaOH, которое содержится в растворе:

Количество вещества щёлочи можно рассчитать сразу:
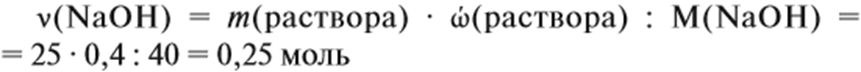
Пусть в смеси содержится а г дигидрофосфата, тогда гидрофосфата содержится (20 — а) г. Подставим эти величины в уравнения реакций и найдём значения х и у:

Поскольку х + у = 0,25 моль, получаем уравнение

Ответ. Смесь состояла из 11,34 г дигидрофосфата и 8,66 г гидрофосфата.
Расчеты массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
Пример 9. Какой объём водорода выделится при взаимодействии 5,4 г алюминия с 200 г 12 %-ного раствора серной кислоты? Чему равны массовые доли веществ в полученном растворе?
В условии задачи указаны данные для обоих (или всех) реагирующих веществ. В этом случае нужно вначале определить количество (в моль) реагирующих веществ. Затем по уравнению реакции определить молярные соотношения этих веществ и сделать вывод — какое из них находится в недостатке. Именно по этой величине (в моль!) следует вести расчёты.
Решение. Определим массы и количество вещества для алюминия и серной кислоты:
Решение. Запишем уравнение реакции:
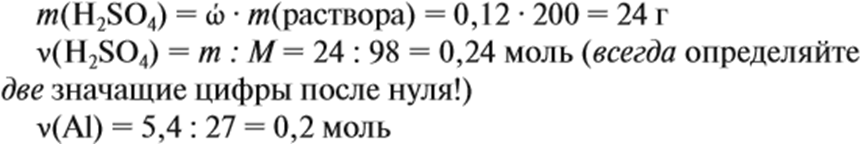
Составим уравнение реакции:

Из уравнения реакции видно, что молярные соотношения исходных веществ 2 : 3, это означает, что 0,2 моль алюминия реагируют полностью с 0,3 моль серной кислоты, но по расчётам этой кислоты имеется только 0,24 моль, т. е. недостаток. Укажем количество вещества серной кислоты (0,24 моль) в уравнении реакции и выполним расчёт по коэффициентам:

Рассчитываем объём водорода. Для того чтобы определить массовые доли растворённых веществ, нужно установить, какие вещества растворимы. В данном случае — это серная кислота и соль. Но серная кислота вступила в реакцию полностью. Массу соли рассчитайте по её количеству вещества. Массу раствора всегда следует рассчитывать по формуле:
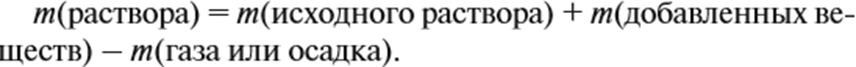
В нашем случае:

Добавляем не ту массу алюминия, которую, добавили в раствор, а ту, которая вступила в реакцию:
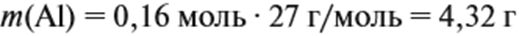
Рассчитайте массу раствора, предварительно рассчитав массу водорода.
Теперь рассчитайте массовую долю соли в полученном растворе:
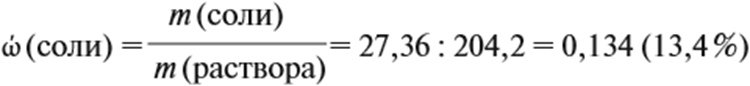
Ответ. Массовая доля сульфата алюминия равна 13,4 %, а объём водорода 5,4 литра.
Пример 10. Установить состав и массу солей, если в раствор, содержащий 28 г КОН пропустить: а) 15 л СО2; б) 10 л СО2; в) 2,5 л СО2.
При взаимодействии щелочей с многоосновными кислотами или их ангидридами могут получаться как средние, так и кислые соли. Если молярное соотношение компонентов 1 : 1, то образуется кислая соль:
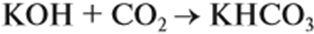
Если щёлочь в избытке (2 : 1 и более), то получается средняя соль:

Поэтому в начале нужно рассчитать количество вещества обоих компонентов:

В первом случае (а) ν (СО2) > ν (КОН), поэтому образуется только кислая соль:
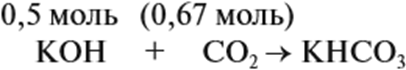
В этом случае углекислый газ находится в избытке, а его избыток не может реагировать дальше. Значит, образуется только кислая соль в количестве 0,5 моль (считаем по «недостатку»).
В третьем случае (в) ν (СО2) < ν (КОН), т. е. когда КОН в избытке, происходят обе реакции. Легко видеть, что 0,11 моль СО2 полностью прореагирует с 0,11 · 2 = 0,22 моль КОН. Поэтому, фактически, идёт только вторая реакция:

и образуется только средняя соль в количестве 0,11 моль.
Во втором случае (б) идут обе реакции:

Здесь остаётся в избытке 0,5 – 0,45 = 0,05 моль КОН, который вступает в следующую стадию процесса

В этой реакции остаётся 0,45 – 0,05 = 0,4 моль КНСО3 и образуется 0,05 моль К2СО3.
Решение задач на установление формулы вещества.
Пример 11. Определить массовую долю азота в нитрате аммония.
Решение. Поскольку в молекуле NH4NO3 два атома азота, а Мr(NH4NO3) = 80,
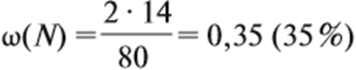
Ответ. ω(N) = 35 %.
Пример 12. Массовая доля фосфора в оксиде равна 43,66 %. Установить формулу этого оксида.
Решение. Из формулы

следует, что:

Поэтому отношение числа атомов n элементов данном в веществе равно:

Находим ώ(О) — массовую долю кислорода в этом оксиде:
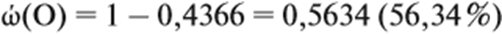
Подставим эти данные в предыдущую формулу:
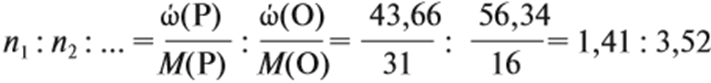
Полученные величины разделим на наименьшее число:
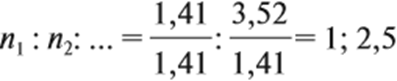
Так как число атомов не может быть дробным, обе величины умножим на 2:

Ответ. Искомая формула — Р2О5.
Пример 13. Установить молекулярную формулу вещества, если оно содержит 54,4 % С, 36,4 % О и 9,1 % Н; D(H2) = 44.
Соотношение числа атомов n элементов в любом веществе равно:

Подставим данные задачи в эту формулу:

Полученные величины разделим на наименьшее число (2,275):

Получаем состав: С2Н4О. М(С2Н4О) = 44 г/моль, а реальная — 88 г/моль, значит, все индексы следует удвоить. Молекулярная формула вещества С4Н8О2.
Пример 14. При полном сгорании 4,6 г органического вещества получили 8,8 г углекислого газа и 5,4 г воды. Найти молекулярную формулу вещества.
Решение. Определим количества и массы веществ, полученных при сгорании:

поскольку 1 молекула воды (1 моль) содержит два атома (2 моль) этого элемента, поэтому m(Н) = 0,6 г. Суммарная масса этих элементов — 3,0 г. Но сгорело 4,6 г вещества, значит, оно содержит кислород (1,6 г). ν(О) = 0,1 моль.
Составим уравнение реакции горения и подставим полученные данные в уравнение реакции:

получаем молярные соотношения продуктов реакции:

Теперь определим соотношение атомов элементов в исходном веществе, которое равно молярному соотношению элементов в этом веществе:

Молекулярная формула вещества С2Н6О.
Пример 15. При полном сгорании 2,9 г органического вещества получили 3,36 л углекислого газа и 2,7 г воды. Плотность по водороду равна 29.
Решение. Сначала рассчитаем молярную массу газа:
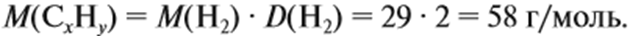
Теперь составим схему реакции, обозначив формулу исходного вещества

Из выделенных параметров составим пропорции, сначала для СО2:

а затем для воды:
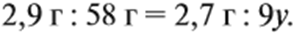
Решив обе, получаем: х = 3, у = 6, т. е. искомая формула С3Н6.
Теперь нужно проверить соответствие полученной формулы заданной молярной массе: М(С3Н6) = 42 г/моль, что явно меньше 58 г/моль. Значит, в состав исходного вещества входит кислород. Его молярная масса: М(О) = 58 – 42 = 16, т. е. в состав вещества входит 1 атом кислорода.
Искомая формула С3Н6О.
Выполните итоговый тест по данной теме, перейдя по ссылке: https://onlinetestpad.com/jnk7gtw4zh45e


0 Комментариев