ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
Вы уже знаете, что атом — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Число электронов в атоме в ходе химических процессов может изменяться, но заряд ядра атома всегда остается неизменным. Зная распределение электронов в атоме (строение атома), можно предсказать многие свойства химического элемента, а также простых и сложных веществ, в состав которых этот элемент входит.
Оглавление
СТРУКТУРА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.МЕНДЕЛЕЕВА.
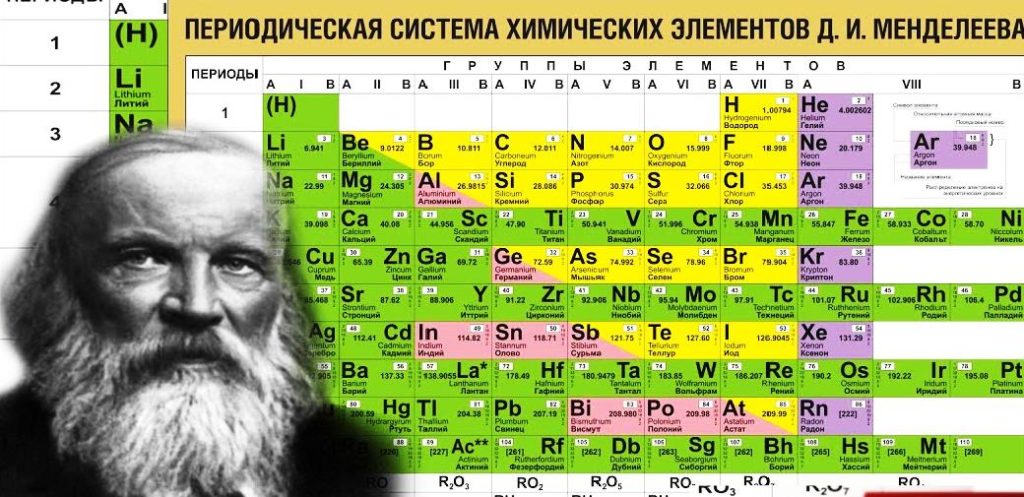
Строение атома, т. е. состав ядра и распределение электронов вокруг яд-ра, можно определить по положению элемента в Периодической системе. В Периодической системе Менделеева химические элементы располага-ются в определённой последовательности. Эта последовательность тесно связана со строением атома этих элементов. Каждому химическому эле-менту в системе присвоен порядковый номер, кроме того, для него можно указать: — номер периода; — номер группы; — вид подгруппы.

Зная точный «адрес» химического элемента, т. е. его группу, подгруппу и номер периода, можно определить строение его атома.
ПЕРИОДЫ.
Период — это горизонтальный ряд химических элементов. В современной Периодической системе семь периодов. Первые три — малые, так как они содержат 2 или 8 элементов:
- 1-й период — Н, Не — 2 элемента;
- 2-й период — Li…Nе — 8 элементов;
- 3-й период — Na…Аr — 8 элементов.
Остальные периоды — большие. Каждый из них содержит 2–3 ряда элементов:
- 4-й период (2 ряда) — К…Кr — 18 элементов;
- 6-й период (3 ряда) — Сs…Rn — 32 элемента. В этот период входит ряд лантаноидов.
ГРУППЫ.
Группа — вертикальный ряд химических элементов. Всего групп восемь. Каждая группа состоит из двух подгрупп: главной подгруппы и побочной подгруппы .
Главную подгруппу (подгруппу А) образуют химические элементы малых периодов и больших периодов. На рисунке 5 показано, что главную подгруппу пятой группы составляют элементы малых периодов (N, P) и больших периодов (As, Sb, Bi).
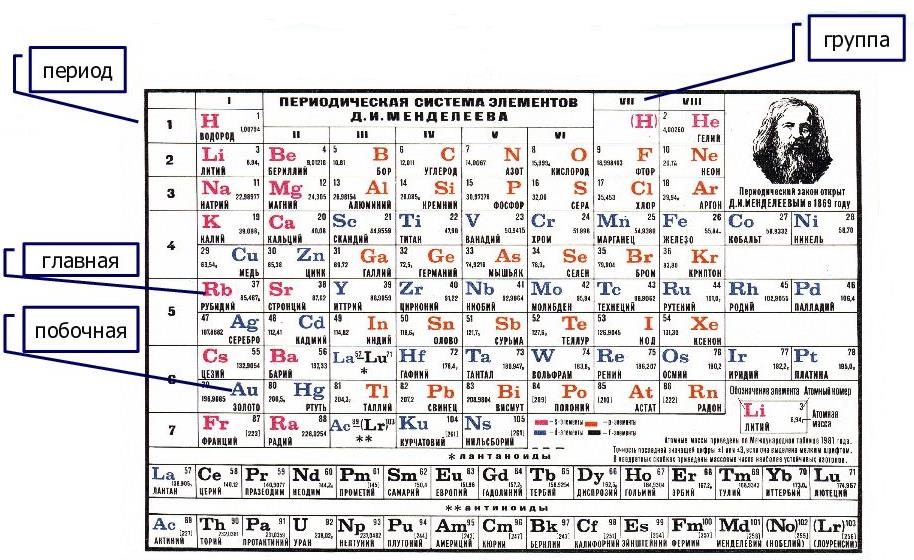
Побочную подгруппу (подгруппу Б) образуют химические элементы только больших периодов. В нашем случае это V, Nb, Ta.
Эти подгруппы различить легко: главная подгруппа «высокая», начинается с первого или второго периода. Побочная подгруппа — «низкая», начинается с 4-го периода.
Главная подгруппа — это вертикальный ряд элементов, атомы которых имеют одинаковое число электронов на внешнем электронном слое. Это число равно номеру группы в ко-торой находятся элементы, кроме Не.
Побочная подгруппа — это вертикальный ряд d-элементов, которые имеют одинаковое суммарное число электронов на d -подуровне предвнешнего слоя и s-подуровне внешнего слоя. Это число обычно равно номеру группы.
s-элементы — это элементы, в атомах которых последним заполняется s-подуровень внешнего электронного слоя.
р-элементы — это элементы, в атомах которых последним заполняется р-подуровень внешнего электронного слоя.
d-элементы — это элементы, в атомах которых последним заполняется d-подуровень предвнешнего электронного слоя.
f-элементы — это элементы, и атомах которых последним заполняется f-подуровень третьего снаружи электронного слоя.
Элементы-аналоги -элементы, которые находятся в одной подгруппе и обладающие не-которыми общими свойствами (одинаковая высшая валентность, одинаковые формулы оксидов и гидроксидов и др.). Эти общие свойства объясняются одинаковым строением внешнего электронного слоя.
Итак, каждый химический элемент Периодической системы имеет свой адрес:
- период;
- группу;
- подгруппу;
- порядковый номер.
Например: ванадий (V) — это химический элемент 4-го периода, V группы, побочной подгруппы, порядковый номер 23.
Выполните задания:
Задание 1. Укажите период, группу и подгруппу для химических элементов с порядковыми номерами 8, 26, 31, 35, 54. Задание 2. Укажите порядковый номер и название химического элемента, если известно, что он находится: в 4-м периоде, VI группе, побочной подгруппе; в 5-м периоде, IV группе, главной подгруппе.
СТРОЕНИЕ АТОМА.
Атом состоит из ядра, которое имеет положительный заряд, и электронов, которые имеют отрицательный заряд. В целом атом электронейтрален. Положительный заряд ядра атома равен порядковому номеру химического элемента. Ядро атома — сложная частица. В ней сосредоточена почти вся масса атома. Поскольку химический элемент — совокупность атомов с одинаковым зарядом ядра, то около символа элемента указывают порядковый номер.

Ядро состоит из протонов и нейтронов. протон (р) имеет массу, равную 1 (1,0073 а. е. м.) и заряд, равный +1; нейтрон (n) заряда не имеет (нейтрален), а масса его приблизительно равна массе протона (1,0087 а. е. м.). Если число протонов можно определить по порядковому номеру, то число нейтронов определяют по разности между величинами: «масса ядра» и «порядковый номер».
Выполните задание:
Задание 3. Определите состав ядер атомов, если химический элемент находится в: 3-м периоде, VII группе, главной подгруппе; 4-м периоде, IV группе, побочной подгруппе; 5-м периоде, I группе, главной подгруппе.

при определении массового числа ядра атома необходимо округлять атомную массу, указанную в Периодической системе!
ИЗОТОПЫ.
Химический элемент — совокупность атомов или ионов с одинаковым зарядом ядра. ОпределитЕ, какие из ядер, состав которых указан ниже, принадлежат одному и тому же химическому элементу:

Атомам одного химического элемента принадлежат ядра А и В, так как они содержат одинаковое число протонов, т. е. заряд этих ядер одинаковый. Масса атома не оказывает существенного влияния на его химические свойства. Поэтому атомы, содержащие одинаковое число протонов, но имеющие разное массовое число или разное число нейтронов, являются ИЗОТОПАМИ этого элемента. В таблице Менделеева указана средняя атомная масса всех природных изотопов данного элемента (Аr). Изотопы и их химические соединения отличаются друг от друга по физическим свойствам, но химические свойства у изотопов одного химического элемента одинаковы. Так, изотоп углерода-14 (14С) имеет такие же химические свойства, как и углерод-12 (12С), который входит в ткани любого живого организма, отличаясь от него только радиоактивностью. Поэтому изотопы применяют для диагностики и лечения различных заболеваний, для научных исследований. Элемент «водород» встречается в природе в виде трёх изотопов: 1Н -протий, 2Н-дейтерий (D), 3Н-тритий (T). Хи- мический элемент «кислород» также представлен тремя природными изотопами: 16O; 17O; 18O.
Вам известно, что ядро атома в химических процессах не меняется. Меняется общее число электронов и распределение электронов. Общее число электронов можно определить следующим образом: оно равно порядковому номеру, т. е. заряду ядра атома:
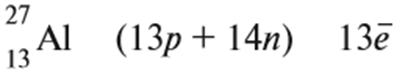
Электроны имеют отрицательный заряд –1, а масса их ничтожна: 1/1840 от массы протона.
СТРОЕНИЕ ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМА.
Отрицательно заряженные электроны отталкиваются и поэтому находятся на разных расстояниях от ядра. При этом электроны, имеющие приблизительно равный запас энергии, образуют энергетический уровень. Число энергетических уровней в атоме равно номеру периода, в котором находится химический элемент. Энергетические уровни условно обозначают так:
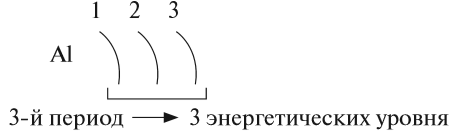
На каждом энергетическом уровне может находиться ограниченное число электронов:
- на первом энергетическом уровне не более 2 электронов;
- на втором энергетическом уровне не более 8 электронов;
- на третьем энергетическом уровне не более 18 электронов.

- на втором энергетическом уровне может находиться от 1 до 8 электронов, но не может быть больше 8 электронов.
- независимо от номера энергетического уровня, на внешнем (последнем) уровне не может быть больше восьми электронов.
- внешний восьмиэлектронный энергетический уровень является наиболее устойчивым и называется завершённым. Такие энергетические уровни имеются у самых неактивных элементов — благородных газов.
- число электронов на внешнем уровне равно:
- для элементов главных подгрупп — номеру группы;
- для элементов побочных подгрупп — оно не может быть больше двух


Нужно уметь правильно определять число внешних электронов, так как именно с ними связаны важнейшие свойства атома. В химических реакциях атомы стремятся «приобрести» устойчивый, завершённый внешний уровень (8ē). Для этого атомы, на внешнем уровне которых мало электронов, «предпочитают» их отдать. Химические элементы, атомы которых способны только отдавать электроны, относятся к МЕТАЛЛАМ. На внешнем уровне атома металла мало электронов: 1, 2, 3. Если на внешнем энергетическом уровне атома много электронов, то такие атомы стремятся принять электроны до завершения внешнего энергетического уровня, т. е. до восьми электронов. Такие элементы относятся к НЕМЕТАЛЛАМ. Металлы и неметаллы главных подгрупп в таблице Менделеева отделяет линия, которую можно провести от бора к астату. Выше этой линии (и на линии) располагаются неметаллы, ниже — металлы.
Для того чтобы составить электронную схему (распределение электронов по уровням и подуровням), следует воспользоваться следующим АЛГОРИТМОМ:
- Определить общее число электронов в атоме (по порядковому номеру).
- Определить число энергетических уровней (по номеру периода).
- Определить число внешних электронов (по виду подгруппы и номеру группы).
- Указать число электронов на всех уровнях, кроме предпоследнего.
- Рассчитать число электронов на предпоследнем уровне.
Например:, согласно пунктам 1…4 для атома марганца определено:

Получили распределение электронов в атоме марганца:

Составляя вышеприведенные схемы строения атома, мы не учитывали, что электроны в атоме занимают не только определённые уровни, но и определённые подуровни каждого уровня. Вид подуровня обозначается латинской буквой: s, p, d.
Число возможных подуровней равно номеру уровня, т. е.
- первый уровень состоит из одного s-подуровня;
- второй уровень состоит из двух подуровней: s и р и т. д.
На каждом подуровне может находиться строго ограниченное число электронов:
- на s-подуровне — не больше 2ē;
- на р-подуровне — не больше 6ē;
- на d-подуровне — не больше 10ē.
Подуровни одного уровня заполняются в строго определённом порядке:

заполнение энергетического уровня всегда начинается с заполнения s-подуровня,после этого начинается заполнение р-подуровня. Электронная конфигурация атома марганца выглядит так:

Обозначения, используемые при написании электронной конфигурации атома:

Составление электронных конфигураций атомов необходимо для того, чтобы определять свойства химических элементов. Поэтому следует помнить: в химических процессах участвуют только валентные электроны. Валентные электроны находятся на внешнем энерге-тическом уровне и незавершённом d-подуровне предвнешнего уровня. Для марганца число валентных электронов равно 7:

или сокращённо:

Чтобы правильно изображать электронные конфигурации различных атомов, нужно знать:
- число электронов в атоме (равно порядковому номеру элемента);
- максимальное число электронов на уровнях, подуровнях;
- порядок заполнения подуровней и орбиталей.

Выполните задания:
Задание 4. Укажите состав ядер этих изотопов водорода и кислорода. Задание 5. Определите число энергетических уровней в атомах кислорода, магния, кальция, свинца. Задание 6. Укажите число внешних электронов для химических элементов с порядковыми номерами 15, 25, 30, 53. Задание 7. Найдите в Периодической системе химические элементы, в атомах которых имеется завершённый внешний уровень. Задание 8. К каким элементам (металлам или неметаллам) относятся химические элементы побочных подгрупп? Почему? Задание 9. Определить, к металлам или неметаллам относятся: фосфор, ванадий, кобальт, селен, висмут. Задание 10. Отработайте алгоритм, составив схемы строения атомов для элементов № 16, 26, 33, 37. Укажите: металлы это или неметаллы? Ответ поясните. Задание 11. Составьте электронные конфигурации атомов для химических элементов № 16, 26, 33, 37.
ЗАВИСИМОСТЬ СВОЙСТВ ЭЛЕМЕНТОВ ОТ СТРОЕНИЯ ИХ АТОМОВ.
Изучив электронную конфигурацию атома марганца, которая отражает распределение его валентных электронов, мы можем определить по этой формуле: 1. Какие свойства — металла или неметалла — преобладают у этого элемента? Ответ: марганец — металл, так как на внешнем (четвёртом) уровне 2 электрона. 2. Какой процесс характерен для металла? Ответ: всегда только отдача электронов. 3. Какие электроны и сколько будет отдавать атом марганца? Ответы: 1. два внешних электрона (они дальше всех от ядра и слабее притягиваются им); 2. семь (2+5) валентных электронов (так как в этом случае на третьем уровне атома останется восемь электронов, т. е. образуется завершённый уже внешний уровень). Эти процессы можно отразить при помощи схемы. Полученные условные заряды атома называются степенью окисления. —

- Металличность — это способность атомов элемента отдавать электроны. Количественной характеристикой металличности элемента является энергия ионизации (I).
- чем меньше электронов в атоме и чем дальше они от ядра, тем сильнее проявляются металлические свойства;
- чем больше внешних электронов в атоме, чем ближе они к ядру, тем сильнее проявляются неметаллические свойства.
- чем больше металличностъ, тем меньше ЭО.
- чем больше неметалличностъ, тем больше ЭО.
- Энергия ионизации атома — это количество энергии, которое необходимо для отрыва электрона от атома элемента (Э), т. е. для превращения атома в положительно заряженный ион. Чем меньше энергия ионизации, тем легче атом отдает электрон, тем сильнее металлические свойства элемента.
- Неметалличность — это способность атомов элемента присоединять электроны. Количественной характеристикой неметалличности элемента является сродство к электрону (Е ).
- Сродство к электрону — это энергия, которая выделяется при присоединении электрона к нейтральному атому, т. е. при превращении атома в отрицательно заряженный ион. Чем больше сродство к электрону, тем легче атом присоединяет электрон, тем сильнее неметаллические свойства элемента.
- Электроотрицательность элемента характеризует способность его атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле.


- Число электронных слоев увеличивается
- Прочность связи электронов внешнего слоя с ядром уменьшается
- Энергия ионизации уменьшается
- Сродство к электрону уменьшается Электроотрицательность уменьшается
- Металличность элементов увеличивается Неметалличность элементов уменьшается

- Заряд ядер атомов увеличивается
- Число электронных слоев атомов не изменяется
- Число электронов на внешнем слое атомов увеличивается от 1 до 8
- Радиус атомов уменьшается
- Прочность связи электронов внешнего слоя с ядром увеличивается
- Энергия ионизации увеличивается
- Сродство к электрону увеличивается
- Электроотрицательность увеличивается
- Металличность элементов уменьшается
- Неметалличность элементов увеличивается
Задания для самопроверки.
- Чему равен положительный заряд ядра атома?
- Почему число протонов в ядре равно числу электронов в атоме?
- Что называется массовым числом атома?
- Что такое изотопы?
- Какова современная формулировка периодического закона?
- Что такое электронная оболочка атома?
- Что называется атомной орбиталью?
- Что такое электронное облако?
- Что такое энергетический уровень?
- Что такое энергетический подуровень?
- Из какого числа орбиталей состоят s-, p-, d-, f — подуровни?
- Что характеризует спиновое квантовое число и какие значения оно принимает?
- Как формулируется принцип Паули?
- Чему равно максимальное число электронов на энергетическом уровне?
- Дайте формулировку правила Гунда. Приведите примеры.
- Что показывают схемы электронного строения атомов?
- Что показывают электронные формулы атомов?
- Что показывают электронно-графические формулы атомов?
- Что такое период?
- Чему равно максимальное число электронов на внешнем электронном слое атома?
- Какой электронный слой называется завершенным?
- Как называются элементы, которые находятся в одной подгруппе?
- Чем объясняются некоторые общие свойства элементов одной главной подгруппы?
- Что такое побочная подгруппа?
- Что такое металличность элементов?
- Что такое неметалличность элементов?
- Что характеризует электроотрицательность?
- Какие электроны называются валентными электронами?
- Чему равен заряд ядра и число электронов в атомах следующих элементов: углерод С, сера S, медь Сu, барий Ва, серебро Ag?
- Назовите элемент, в ядре атома которого содержится 11 протонов.
- Назовите элемент, в атоме которого содержится 26 электронов.
- Сколько электронов и протонов входит в состав атома элемента, который находится: а) в 5-м периоде и в побочной подгруппе VI группы; б) в 4-м периоде и в главной подгруппе III группы.
- В каком электронном слое — внешнем или предвнешнем — происходит увеличение числа электронов в атомах ряда элементов от 21Sc до 30Zn?
- Сколько электронов находится на внешнем электронном слое в атомах ряда элементов от 21Sc до 30Zn?
- По положению элементов в периодической системе определите число электронных слоёв и число электронов на внешнем электронном слое в атомах: а) углерода 6С; б) серы 16S; в) цезия 65Cs; г) кальция 20Са; д) висмута 83Bi. Напишите для каждого из этих элементов электронную и электронно-графическую формулы внешнего электронного слоя.
- Укажите, к какому электронному семейству относится каждый из следующих элементов: а) 6С; б) 56Ва; в) 41Nb; r)35Br. Какой подуровень заполняется последним в атомах этих элементов?
- По электронной формуле внешнего электронного слоя атома определите, какой это элемент. Напишите его название, символ и порядковый номер: a) 3s23p4; б) 4s24p6; B)2s22p1. К какому электронному семейству относится каждый из этих элементов?
- У какого элемента начинается заполнение 4р-подуровня и у какого элемента заканчивается? Определите положение элементов в периодической системе (период, группа, подгруппа) по электронным формулам: а) ls22s22p63s23p4; б) ls22s22/3s23/4s23d5 (или ls22s22p63s23p63d54s2); в) ls22s22/3s23p64s23d10 (или ls22s22/3s23/3d104s2);
- По положению элементов в периодической системе определите, какой элемент имеет большую ЭО; больший радиус атома: а) йод 53I или бром 35Вг; б) олово 50Sn или йод 53I; Ответ объясните.
- В главных подгруппах двух групп находятся только металлы. Какие это группы?
- Как изменяется число элементов-неметаллов в главных подгруппах I—VII групп?
- Напишите символы всех элементов, атомы которых содержат пять валентных электронов. Напишите формулы высших оксидов этих элементов.
- Какой из двух элементов обладает более выраженными неметаллическими свойствами: а) С или Si; б) Сl или I и) N или As?
Для закрепления пройденного материала Вам необходимо перейти по ссылке здесь: https://learningapps.org/watch?v=ph5huqo1c22 и выполнить работу.


0 Комментариев