АМИНЫ.
Амины – класс органических соединений, производные аммиака (NH3) и гидрата аммиака NH3⋅H2O, у которых один или несколько атомов водорода замещены на углеводородный радикал. Общая формула гомологического ряда CnH2n+3N.
Строение и классификация аминов.
Поскольку амины являются продуктами замещения водорода в аммиаке, то все они являются донорами электронной пары, принадлежащей атому азота, то есть проявляют свойства оснований (по Льюису).

Классификация аминов.
1. По степени замещенности атомов водорода в молекуле аммиака на
- первичные амины (NH2R);
- вторичные (NHR1R2)
- третичные (NR1R2R3)
- четвертичные соли аминов

Радикалы, входящие в молекулу амина могут быть одинаковыми или разными.
2. По типу радикала выделяют амины алифатического и ароматического ряда. Типичным представителем ряда ароматических аминов является анилин C6H5−NH2.

Изомерия алифатических аминов.
Для алифатических аминов характерны следующие виды изомерии:
- углеродного скелета (степени разветвленности углеводородного радикала) начиная с C4H9NH2

- положение аминогруппы, начиная с C3H7NH2

- изомерия аминогруппы (межклассовая изомерия), связанная с изменением степени замещенности атомов водорода при азоте. Поэтому первичные, вторичные и третичные амины изомерны друг другу:

- пространственная изомерия (оптическая, начиная с бутиламина)

Номенклатура аминов.
1. По систематической номенклатуре амины называют путем добавления суффикса «амин» к названию углеводорода. 2. По рациональной номенклатуре их рассматривают как алкил- или ариламины.

У ароматических аминов в основе названия также лежит слово амин, кроме того такие соединения имеют тривиальные названия:

3. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. Аминогруппа при этом рассматривается как заместитель, а ее местоположение указывается цифрой в начале названия.
Например: H2N−CH2−CH2−CH2−CH2−NH2 1,4-диаминобутан
Физические свойства.
Первые представители ряда аминов — метиламин, диметиламин и триметиламин – газы. Остальные низшие амины – жидкости. Обладают резким характерным удушливым запахом. Канцерогены. Высшие амины – твердые вещества, без запаха. Первые предста-вители аминов хорошо растворимы в воде. Высшие амины в воде не растворяются. Это связано с тем, что связь N–H более полярна, чем связь С–H, но менее полярна, чем связь C–O, поэтому водородные связи между молекулами аминов выражены слабее, чем в мо-лекулах спиртов.

Для усвоения изучаемого материала посмотрите видео-урок, перейдя по ссылке: https://yandex.ru/video/preview/8519438500183996458
Восстановление нитросоединений
Получение аминов.
Первичные амины получают восстановлением нитросоединений.
- Гидрирование водородом: СН3-СН2-СН2-СН2-NO2 + 3H2 →СН3-СН2-СН2-СН2-NH2 + 2 H2O
- Восстановление сульфидом аммония: СН3-СН2-NO2 +3 (NH4)2S → СН3-СН2-NH2 + 3 S + 6 NH3 + 2 H2O
- Алюминий в щелочной среде. СН3-СН2-NO2 +2 Al + 2 KOH + 4 H2O → СН3-СН2-NH2 +2 K[Al(OH)4]
- Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте. СН3-СН2-NO2 + 3 Fe + 7 HCl → [СН3-СН2-NH3]Cl + 2 H2O + 3 FeCl3 В результате образуется соль. При ее взаимодействии с щелочью образуется амин. [СН3-СН2-NH3]Cl + KOH → СН3-СН2-NH2 + H2O + KCl
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком: СН3-СН2-СН2-СН2-Br + NH3 → [СН3-СН2-СН2-СН2-NH3]Br [СН3-СН2-СН2-NH3]Br + KOH → СН3-СН2-СН2 -NH2 + H2O + KBr При избытке аммиака амин образуется сразу. R-Br + 2NH3 → R-NH2 + NH4Br
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:

Реакция проходит в жестких условиях в присутствии катализатора.

Для усвоения изучаемого материала посмотрите видео-урок, перейдя по ссылке: https://yandex.ru/video/preview/3864671412302279318
Химические свойства аминов.
Свойства аминов как оснований
Химические свойства алифатических аминов определяются главным образом наличием у атома азота неподеленной пары электронов.За счет неподеленной пары электронов атома азота амины способны присоединять протон, проявляя при этом основные свойства. Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму.
Амины – органические основания.
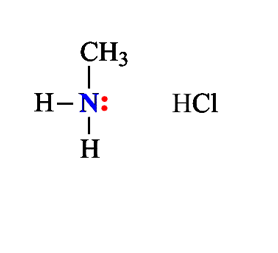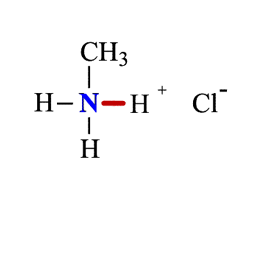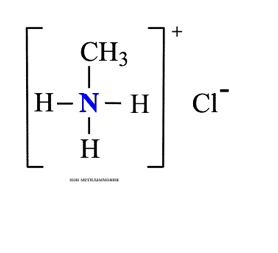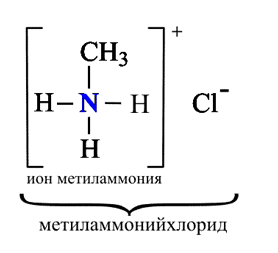
1. Взаимодействие с водой
Водные растворы алифатических аминов (алкиламинов) имеют щелочной характер, т.к. при взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
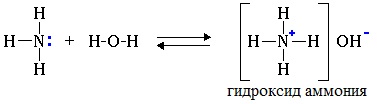
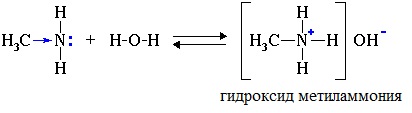
Механизм реакции
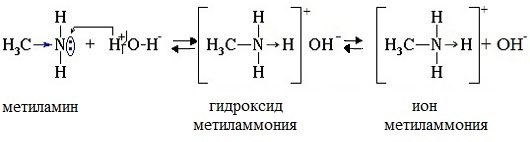
Общее уравнение реакции
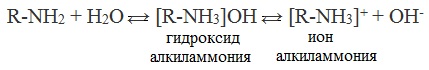
Амины изменяют окраску индикаторов.
2. Взаимодействие с кислотами (реакция нейтрализации)
Алкиламины как основания образуют соли с минеральными кислотами, которые являются аналогами солей аммония:
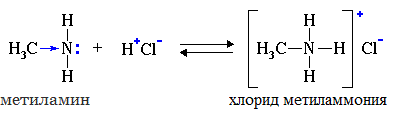

С органическими кислотами возможны аналогичные реакции:

Соли аминов – твердые вещества, хорошо растворимые в воде и плохо растворимые в неполярных органических растворителях. Щелочи, как более сильные основания, вытесняют амины из их солей:
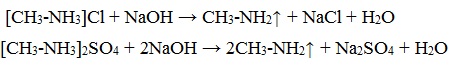
Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде.
II. Окисление аминов
Алифатические амины окисляются под действием сильных окислителей. В отличие от аммиака, низшие газообразные амины способны воспламеняться от открытого пламени.
Реакция горения (полное окисление)
Продуктами горения аминов, как и других азотсодержащих органических соединений, являются углекислый газ, вода и свободный азот:
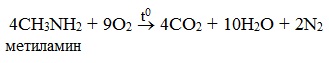
III. Взаимодействие с азотистой кислотой (отличие первичных аминов от вторичных и третичных)
Качественная реакция на амины!
Азотистая кислота HNO2 — неустойчивое соединение, поэтому ее получают непосредственно в процессе реакции действием сильной минеральной кислоты (НСl, H2SO4) на соль азотистой кислоты (нитрит):
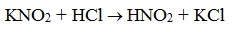
Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов. Важное практическое значение имеет реакция азотистой кислоты с первичными ароматическими аминами.
При действии азотистой кислоты на первичные амины выделяется свободный азот и образуются спирты:
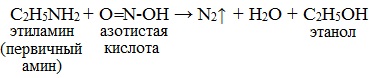
Вторичные амины с азотистой кислотой дают N-нитрозамины – маслянистые жидкости с характерным запахом:
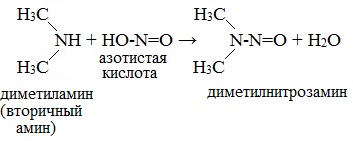
Третичные алифатические амины с азотистой кислотой не реагируют.

Для усвоения изучаемого материала посмотрите видео-урок, перейдя по ссылке:https://yandex.ru/video/preview/5174954731458332922
Основные представители ряда аминов.
Алкиламины
Метиламин CH3−NH2 — при нормальных условиях бесцветный газ с запахом аммиака. Как правило используется в виде растворов: 40 % масс в воде, в метаноле, этаноле или ТГФ (тетрагидро-фуране). Метиламин применяется для синтеза пестицидов, лекарств, красителей. Наиболее важными из продуктов являются N-Метил-2-пирролидон (NMP), метилформамид, кофеин, эфедрин и N,N’-диметилмочевина.
По своим химическим свойствам метиламин является типичным первичным амином, то есть подобно аммиаку, образует четвер-тичные соли с кислотами и реагирует с водой, образуя донорно-акцепторную связь, при взаимодействии со сложными эфирами или ацилхлоридами дает амиды.
Триметиламин (CH3)3N, подобно другим низкомолекулярным аминам, является газом с аммиачным, или «рыбным» запа-хом, образуется в природе при разложении рыбы. В промышленности триметиламин получают взаимодействием метило-вого спирта или диметилового эфира с аммиаком; используют для производства бактерицидов, флотореагентов, кормовых добавок.
Амины образуются в растениях и животных в результате биохимического распада аминокислот под действием ферментов. Они обладают высокой биологической активности. Амины животного происхождения – серотонин, адреналин, мелатонин, тирамин и др. Амины растительного происхождения – кофеин, кокаин, никотин, хинин и др. Практически все амины ядо-виты. Ароматический амин анилин проникает через кожу, окисляет гемоглобин, угнетает работу центральной нервной системы. Его действие может привести к гибели. Отравление можно выявить по следующим признакам: трудности при ды-хании, посинение носа, губ, кончиков пальцев, сильное сердцебиение, обмороки. Первая помощь: смыть анилин спиртом, дать возможность дышать чистым воздухом, вызвать медицинских специалистов. Алифатические амины оказывают нега-тивное влияние на нервную систему, нарушают работу печени, развивают дистрофию. Некоторые ароматические амины — канцерогены, способные вызвать рак мочевого пузыря. Опасны даже пары аминов.
АРОМАТИЧЕСКИЕ АМИНЫ. АНИЛИН.

Анилин – это соединение, которое относят к органическим веществам. Принадлежит к классу аминов. Чтобы понять, что такое амины, можно представить формулу аммиака, затем один атом водорода или все заменить углеводородным ради-калом. Анилин (фениламин) — понятие, строение, физические свойства Если в формуле аммиака только один водородный атом заме-нить фенил радикалом, получится анилин (фениламин). Поэтому его можно считать производным аммиака. Вещество называют также аминобензол.

Можно иначе представить это соединение. Если в формуле бензола вместо одного водорода поставить аминогруппу, полу-чается анилин. Значит это производная бензола, где атом водорода замещается на аминогруппу. Эмпирическая (молеку-лярная) формула фениламина C6H5NH2. Его записывают с помощью структурной формулы: Аминобензол содержит две группы атомов: аминогруппу и фенил радикал. Они оказывают влияние на свойства вещества. Аминогруппа NH2– состоит из атома азота и двух атомов водорода. У азота на внешнем энергетическом уровне содержится 5 электронов. Два электрона образуют химическую связь с атомами углерода, один электрон образует связь с углеродом фенил радикала. У него еще остаётся два электрона. Они образуют свободную пару электронов.
Аминогруппа в составе анилина может присоединять протон водорода. Поэтому соединение проявляет свойства оснований. Так как по определению, вещества, присоединяющие протон водорода, принято считать основаниями. Фенил радикал C6H5 – имеет в своём составе бензольное кольцо. Благодаря этому фениламин должен вступать в реакции, характерные для бензола. Так как 2 группы ато-мов находятся в одном соединении, они ока-зывают влияние друг на друга. Фенил радикал, влияя на функциональную группу, вовле-кает свободную пару электронов в π — электронную систему. Такое смещение плотности влияет на проявление свойств соединения как основания. В результате фениламин не вступает во взаимодействие с водой. Аммиак, таким образом, более сильное основание. Функ-циональная группа влияет на π — систему. Нарушается равномерное распределение электронной плотности. Она повышается у атомов 2,4,6 (в орто — и пара — положениях). Именно здесь будет идти замена водорода на другие атомы в химических реакциях.

Фениламин — это жидкость, маслянистая и ограниченно раство-ряющаяся в воде. Растворяется в органических соединениях. Кипит при температуре 1840С, замерзает при температуре –60°С. При окислении окрашивается в красно-бурый цвет. Молярная масса 93 г/моль. Плотность вещества при 200°С состав-ляет 1,02173 г/см3. Вещество ядовито. Его относят ко второму классу опасности. При контакте с кожей может вызвать аллергию. При попадании в организм вызывает отравление. Есть информация о том, что оно может вызвать генетические мутации, возникает риск возникновения раковых заболе-ваний. Его называют ядом крови, так как вызывает кислородное голодание.
Получение анилина.
Фениламин получают из нитробензола. Этот способ был предложен русским учёным Н. Н. Зининым. Поэтому получил название «реак-ция Зинина». Проводят взаимодействие железа с нитробензолом в присутствии соляной кислоты. Идёт восстановление нитробензола до анилина. Синтез можно представить уравнениями реакций: Fe + 2HCl = FeCl2 + 2H С6Н5NO2+6H=C6H5NH2+2H2O


При взаимодействии анилина с галогеналканами и спиртами получают смесь вторичных, а также третичных аминов. Такое превраще-ние носит название алкилирование.

Для вещества характерны две группы свойств.

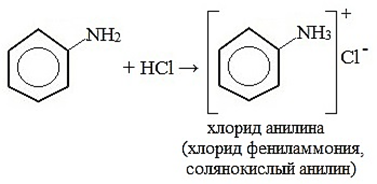
Реакции, идущие за счёт функциональной группы: Фениламин взаимодействует с кислотами. В результате образуются соли. При взаимодействии анилина с хлороводородной кислотой получается хлорид фениламмония, или анилин солянокислый: C6H5NH2+HCl=(C6H5 NH3)+Cl—
Получение аммониевых соединений с галогенопроизводными


N-алкилирование аминов, получение вторичных и третичных аминов:
N-ацилирование аминов, получение N-замещенных амидов:

Реакции,идущие за счёт фенил-радикала.
Химические свойства анилина.
Для фениламина характерна реакция замещения, например бромирование. В результате получают 2,4,6 триброманилин. Образуется осадок белого цвета, поэтому реакцию считают качественной на обнаружение данного вещества. Уравнение реакции с бромом выг-лядит следующим образом: C6H5NH2 +3 Br2 = C6H2Br3NH2 + 3HBr

Нитрование, при котором происходит замещение в кольце ароматических аминов:

Вступает во взаимодействие с азотной кислотой, образуя тринитроанилин:

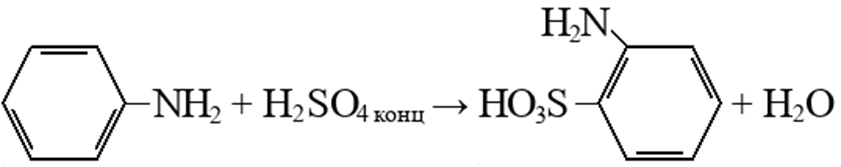

Применение анилина.
Большая часть фениламина идёт для синтеза красителей. Его используют в получении типографской краски и синтетических краси-телей для текстильной промышленности.

Так в кислой среде анилин окисляется дихроматом калия, в результате получается чёрный краситель. Эта реакция также рассматрива-ется как качественная на фениламин: 6C6H5NH2+4K2Cr2O7+19H2SO4 = 6C6H4O2 + 4K2SO4 + 4Cr2(SO4)3 + 3(NH4)2SO4 + 16H2O

Вещество является исходным для получения лекарственных пре-паратов. Сульфаниламидные соединения, получаемые на основе анилина, используют в медицине в качестве лекарств. Это производные анилина. К ним относятся: парацетамол, фенацетин и другие. Также на основе соединения производят химические средства защиты растений, различные смолы, крем для обуви, взрывчатые ве-щества.

Для усвоения изучаемого материала посмотрите видео-урок, перейдя по ссылке: https://yandex.ru/video/preview/13234782084068702196
Для закрепления изученного материала перейдите по ссылке: https://learningapps.org/watch?v=przchf1vj23 и выполните задания.


0 Комментариев