АЛКАДИЕНЫ.
Молекула углеводорода может содержать не одну, а несколько двойных связей. Их принято называть диеновыми углеводородами. Диеновые углеводороды или алкадиены – это непредельные углеводороды, содержащие две двойные углерод — углеродные связи.

Оглавление
Классификация алкадиенов.
В зависимости от взаимного расположения двойных связей диены подразделяются на три типа:
1. Алкадиены с кумулированными двойными связями — если две двойные связи прилежат к одному и тому же атому углерода. (пропадиен-1,2 (аллен) — CH2=C=CH2 ). В молекуле аллена крайние атомы углерода находятся в состоянии sp2-гибридизации, а центральный атом — sp-гибридизации.
2. Алкадиены с сопряженными двойными связями — если две двойные связи разделены одной одинарной связью. В результате такого взаиморасположения в молекулах возникает сопряжение: формируется единое π-электронное облако. Сигма-связи (σ-связи) перекрываются вдоль линии плоскости, а пи-связи (π-связи) над и под линией плоскости (линией, соединяющей центры атомов).
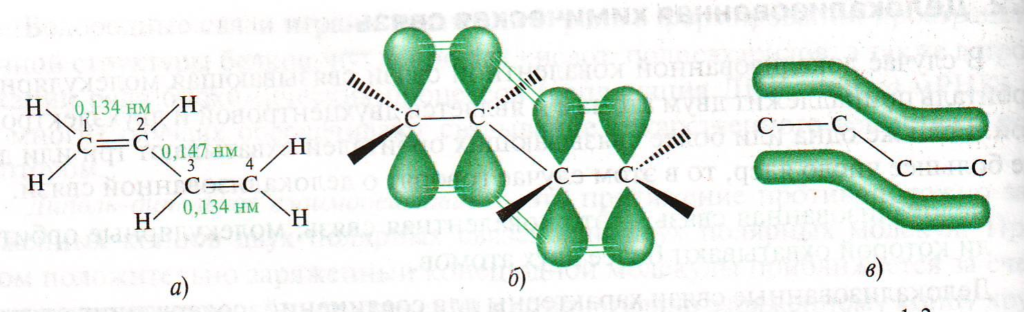
3. Алкадиены с изолированными двойными связями — если две двойные связи разделены двумя и более одинарными связями (пента-диен-1,4 — CH2=CH-CH2-CH=CH2 ).

Для лучшего усвоения учебного материала, посмотрите видео-урок по ссылке: https://yandex.ru/video/preview/1680934009675952260
Изомерия алкадиенов.
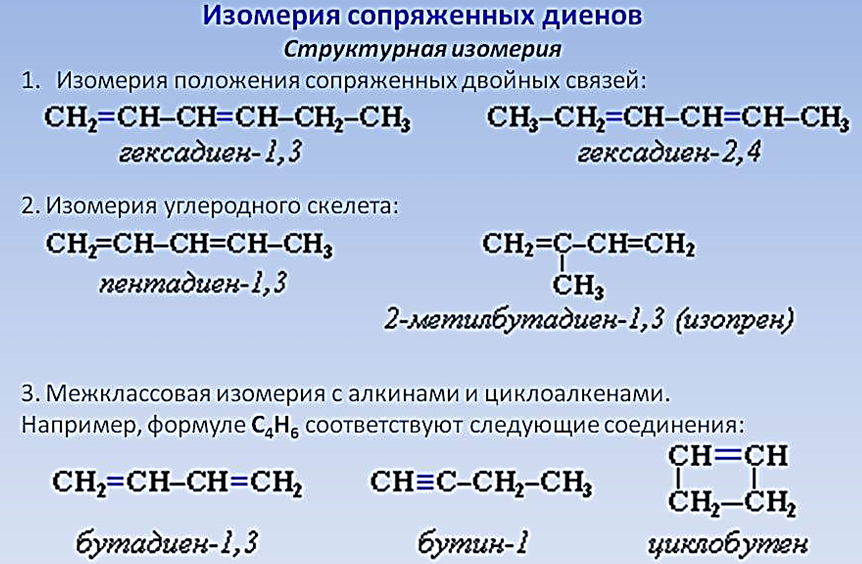
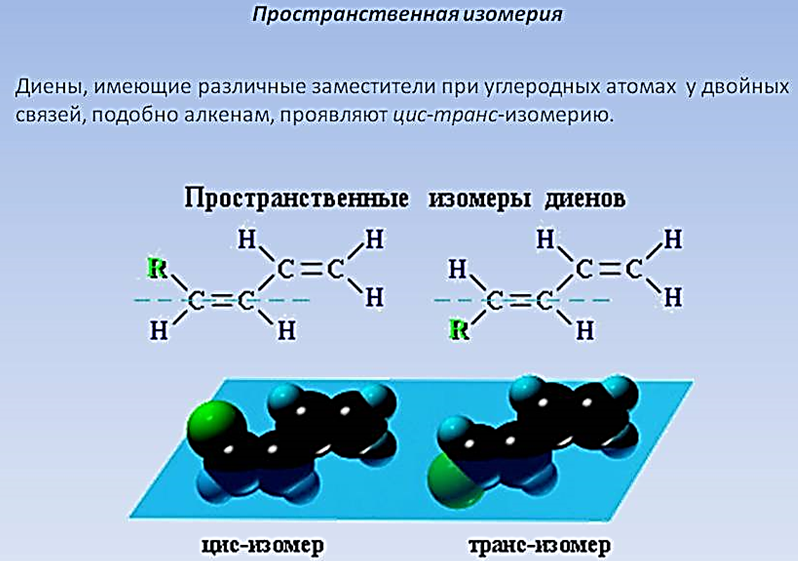
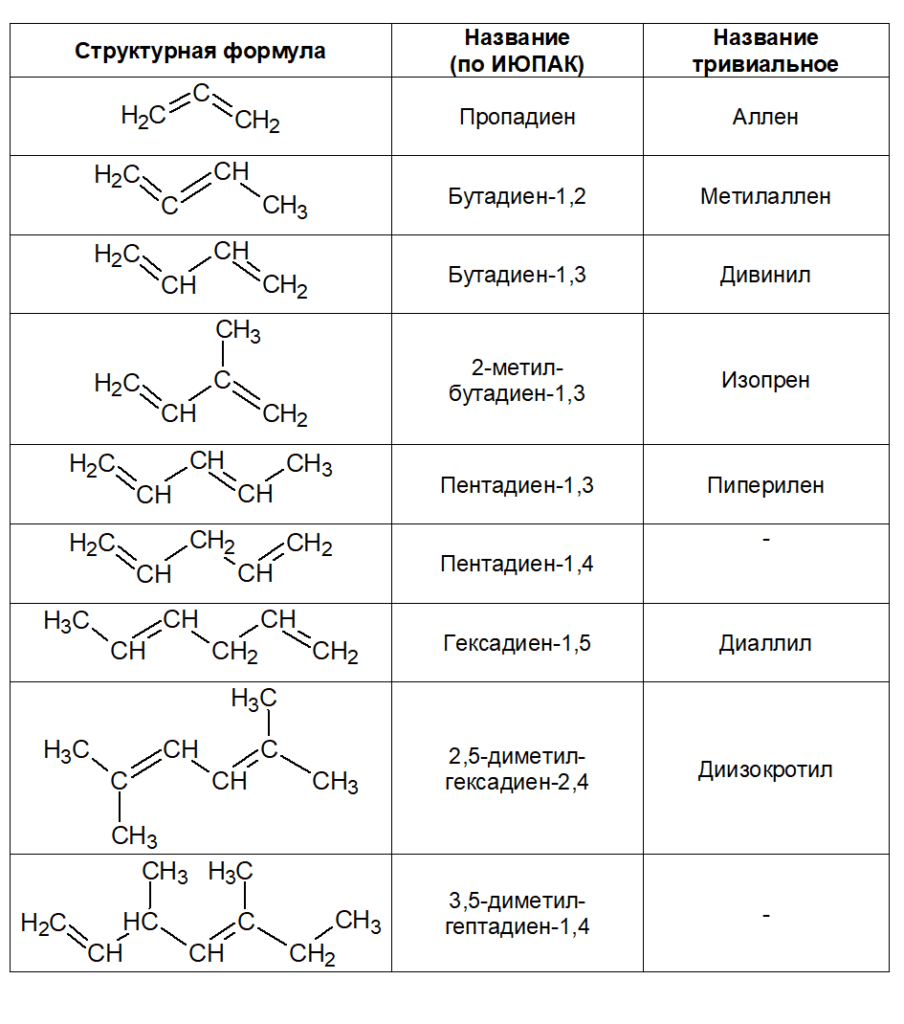
Номенклатура алкадиенов.
По правилам ИЮПАК главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствую-щих алканов, заменяя окончание –ан на –диен.
Местоположение двойных связей указывается в конце названия, а заместителей – в начале названия.

Для бутадиена-1,3 существует тривиальное название дивинил, потому что его молекулу можно представить состоящую из двух непредельных радикалов – винилов. А приставка ди означает два – два винила.

Физические свойства алкадиенов.
Первый член гомологического ряда алкадиенов аллен — бесцветный газ, бутадиен–1,3 — легко сжижающийся газ с неприятным запахом, изопрен — жидкость с t кип. = 34o C. Высшие алкадиены — твёрдые вещества. Алкадиены не растворяются в воде, но хорошо растворяются в неполярных органических растворителях.
Химические свойства алкадиенов.
По химическим свойствам диеновые углеводороды подобные этиленовым. Поэтому для них также характерны реакции присоеди-нения. Атомы углерода в молекуле бутадиена-1,3 находятся в sp2 — гибридном состоянии, что означает расположение этих атомов в одной плоскости и наличие у каждого из них одной р-орбитали, занятой одним электроном и расположенной перпендикулярно к упомянутой плоскости. Взаимодействие двух или нескольких соседних p-орбиталей с образованием единого p- электронного облака, в результате чего происходит передача взаимовлияния атомов в этой системе, называется эффектом сопряжения.
Как и алкены, диены вступают в реакции присоединения, обесцвечивают бромную воду и раствор перманганата калия. Химические свойства алкадиенов с изолированными двойными связями не отличаются от свойств алкенов, но отличие состоит в том, что реакции могут проходить по двум двойным связям независимо друг от друга.
Однако, реакции присоединения к алкенам с сопряжёнными связями имеют особенности, а именно: в зависимости от условий присоединение может протекать по двум направлениям: по одной из двойных связей (1,2–присоединение) и по крайним атомам сопряженной системы с перемещением двойной связи в центр этой системы (1,4–присоединение):

Гидрирование — присоединение водорода в мольном соотношении 1:2 приводит к образованию соответствующего алкана:

Галогенирование — галогены также способны присоединяться к сопряженным системам в 1,2- и 1,4-положения, причем количество 1,4-продукта зависит от строения диенового углеводорода, природы галогена и условий реакции. Выход продукта 1,4-присоединения возрастает при повышении температуры (до известного предела) и при переходе от хлора к иоду:
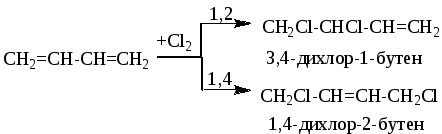
Гидрогалогенирование — присоединение галогеноводорода. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
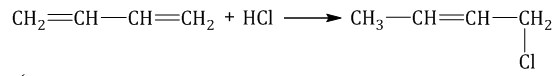
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова. Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с обра-зованием высокомолекулярного вещества (полимера). Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком. Продукт полимеризации дивинила (бутадиена) называ-ется искусственным каучуком:
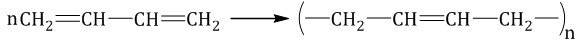
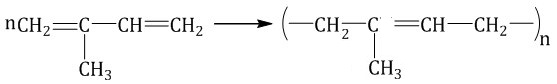
При полимеризации изопрена образуется природный (натуральный) каучук:
Окисление алкадиенов. Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кис-лорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).В зависимости от интенсив-ности и условий окисление можно условно разделить на мягкое и жесткое.
Мягкое окисление алкадиенов — протекает при низкой температуре в присутствии перманганата калия. При этом раствор пермангана-та обесцвечивается. В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
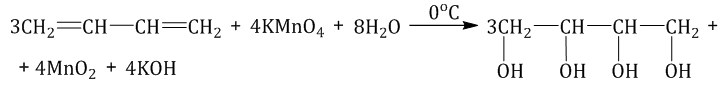
Жесткое окисление — под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода. Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекис-лого газа:
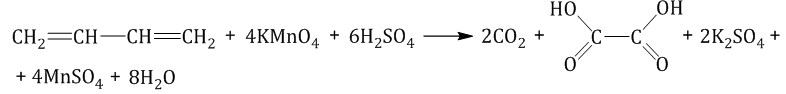
Горение алкадиенов — алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды. В общем виде уравнение сгорания алкадиенов выглядит так: CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O + Q. Уравнение горения бутади-ена: 2C4H6 + 11O2 → 8CO2 + 6H2O.

Для лучшего усвоения учебного материала, посмотрите видео-урок по ссылке: https://yandex.ru/video/preview/16497003907861305533 и по ссылке: https://yandex.ru/video/preview/14143022831892527065
Получение алкадиенов.
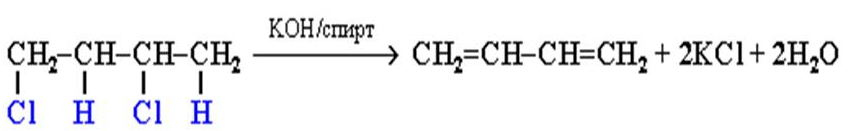
Алкадиены получают несколькими способами: Дегидрогалогенирование дигалогеналканов — в результате реакции молекулы алкана, содержащей два атома галогена, со спиртовым (!) раствором щелочи получается алкадиен. В зависимости от положения галогенов возможны разные варианты. Отщепление идет по правилу Зайцева: атом водорода отщепляется от соседнего, наименее гидрированного атома углерода.
Синтез С.В. Лебедева. Сергей Васильевич Лебедев в 1927 году разработал первый промышленный способ получения синтетического каучука из этилового спирта: 2CH3-CH2-OH → (450 °C, кат. ZnO) CH2=CH-CH=CH2 + 2H2O + H2
Каучук занимает важное место в промышленности благодаря своим свойствам: водонепроницаемости, эластичности и способности к электроизоляции. Путем вулканизации из каучука получают резину, используемую повсеместно.

Дегидрирование алканов — в результате отщепления водорода от молекулы алкана образуются двойные связи. Дегидрирование происходит при повышенной температуре и в присутствии катализатора.
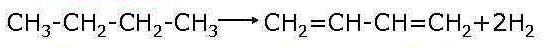

Для лучшего усвоения учебного материала, посмотрите видео-урок по ссылке: https://yandex.ru/video/preview/8028507924932707161


0 Комментариев