РАСТВОРЫ. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.

ПОНЯТИЕ О РАСТВОРАХ.
Растворы широко применяются в различных сферах деятельности человека. Они имеют большое значение для живых организмов. Человек, животные и растения усваивают питательные вещества в виде растворов. Сложные физико-химические процессы в организмах человека, животных и растений протекают в растворах. Растворами являются физиологические жидкости — плазма крови, лимфа, желудочный сок и др. В медицине применяются водные растворы солей, которые по составу соответствуют плазме крови. Эти растворы называются физиологическими. Их вводят в кровь при некоторых заболеваниях. Многие медицинские препараты являются растворами различных химических веществ в воде или спирте. Природная вода является раствором. Минеральные воды, которые представляют собой растворы углекислого газа, сероводорода, соединений железа, брома, йода и других веществ, применяют при лечении различных заболеваний.
Оглавление
В различных производственных и биологических процессах большую роль играют растворы электролитов. Свойства этих растворов объясняет теория электролитической диссоциации.
Растворы — гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов.

Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкости) и растворенных веществ (газообразных, жидких, твёрдых).

- Водные растворы — это растворы, в которых растворителем является вода.
- Неводные растворы — это растворы, в которых растворителями являются другие жидкости (бензол, спирт, эфир и т. д.).
- Растворение — сложный физико-химический процесс.
- Физический процесс протекает с поглощением теплоты, химический- с выделением.
- Разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя — это физический процесс.
- Взаимодействие молекул растворителя с частицами растворенного вещества- химический процесс. В результате этого взаимо-действия образуются сольваты.
- Сольваты — продукты переменного состава, которые образуются при химическом взаимодействии частиц растворенного вещества с молекулами растворителя.
- Если растворителем является вода, то образующиеся сольваты называются гидратами.
- Процесс образования сольватов называется сольватацией.
- Процесс образования гидратов называется гидратацией.
- Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами.
- Вода, входящая в их состав, называется кристаллизационной водой.
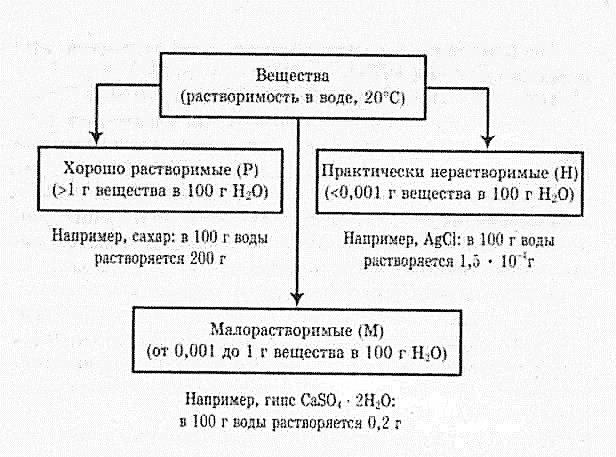
- Насыщенный раствор — это раствор, который содержит максимальное количество растворяемого вещества при данной температуре.
- Ненасыщенный раствор — это раствор, который содержит меньше растворяемого вещества при данной температуре.
- Количественной характеристикой растворимости является коэффициент растворимости.
- Коэффициент растворимости показывает, какая максимальная масса вещества может раствориться и 100 г растворителя при данной температуре.
- Растворимость в воде выражают в граммах вещества на 100 г воды (г/100 г Н20).
- По растворимости в воде вещества делят на 3 группы:
КОЛИЧЕСТВЕННАЯ ХАРАКТЕРИСТИКА СОСТАВА РАСТВОРОВ.
- Разбавленный раствор — содержит мало растворенного вещества.
- Концентрированный раствор — содержит много растворенного вещества.
- Массовой долей растворенного вещества называется отношение массы растворенного вещества к массе раствора.

где ω — массовая доля растворенного вещества, выраженная в долях единицы; m(в-ва) — масса растворенного вещества, г; m(р-ра) — масса раствора, г.
- Процентная концентрация раствора — массовая доля растворенного вещества, выраженная в процентах.

- Молярная концентрация показывает число молей растворенного вещества в одном литре раствора.

где С — молярная концентрация, моль/л; п — количество растворенного вещества, моль; V — объем раствора, л.

- Если даны объем раствора и его плотность, то массу раствора рассчитывают по формуле:

РЕШЕНИЕ ЗАДАЧ по теме «СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ».
Задача 1. В 175 г воды растворили 25 г нитрата калия. Чему равна массовая доля КNО3 в полученном растворе?
Решение:
- Находим массу раствора. Масса раствора складывается из массы растворителя (воды) и массы растворенного вещества (КNО3):

2. Находим массовую долю КN03 :

массовую долю можно выразить в процентах:

Задача 2. В медицинской практике широко применяется физиологический раствор, представляющий собой водный раствор хлорида натрия, в котором ω(NaCl) = 0,9%. Плотность этого раствора 1,01 г/см3. Какая масса хлорида натрия и какой объем воды потребуются для приготовления 3 л физиологического раствора.
Решение:
По условию задачи:

Задача 3.
При комнатной температуре в 1 л воды может раствориться 350 л хлороводорода (объем приведен к нормальным условиям). Какова массовая доля НС1 в образующемся растворе?
Решение:
1. Определим массы воды и хлороводорода:
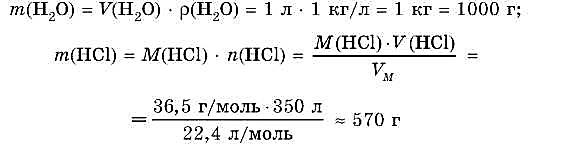
2. Масса раствора равна:
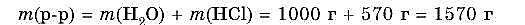
3. Массовая доля НСl в растворе составляет:

4. Таким образом, при растворении 350 л НСl в 1 л воды образуется 36%-ная соляная кислота.
Задача 4.
В 300 мл воды растворили 12,5 г медного купороса СиSО4∙5Н2О. Какова массовая доля СиSО4 в полученном растворе?
Решение:
Для приготовления растворов часто используют кристаллогидраты. Зная молярные массы кристал-логидрата и безводной соли, несложно рассчитать массу безводной соли в данной массе кристаллогидрата. В данном случае:

Задача 5.
Какие массы 15%-ного раствора хлорида натрия и воды необходимы для приготовления 500 г 12%-ного раствора NaС1?
Решение:


Задача 6.
При охлаждении 300 г 15%-ного водного раствора часть растворенного вещества выпала в осадок и массовая доля его в растворе уменьшилась до 8%. Чему равна масса выпавшего в осадок вещества?
Решение:
Рассчитаем массы растворенного вещества и растворителя в исходном растворе:

При понижении температуры растворимость большинства твердых веществ уменьшается, поэтому при охлаждении раствора часть растворенного вещества может выпадать в осадок; масса растворителя в исходном растворе при этом не изменяется. Пусть масса вещества, оставшегося в растворе,

тогда масса раствора после охлаждения
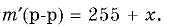
Поскольку массовая доля вещества в этом растворе составила 8% (0,08), можно записать уравнение:

Масса вещества, выпавшего в осадок, равна:

Задача 7.
В 300 мл раствора содержится 8,4 г гидроксида калия. Чему равна молярная концентрация КОН в этом растворе?
Решение:
1. Находим количество вещества КОН

2. Находим молярную концентрацию раствора:

Такой раствор называется полумолярным раствором.
Задача 8.
Сколько граммов нитрата калия содержится в 2,5 л децимолярного раствора?
Решение:
1. Из уравнения

следует, что:

Децимолярным называется раствор, молярная концентрация которого равна 0,1 моль/л. В данном случае: С(КNО3) = 0,1 моль/л. Масса КNО3 равна:

Задача 9.
Какие объемы 2М и 6 М растворов НСl нужно смешать для приготовления 500 мл 3М раствора?
Решение:
1. Рассчитаем число молей НСl в 500 мл 3М раствора: n(НСl) = С(НСl) ∙ V(р-р) = 3 моль/л ∙ 0,5 л = 1,5 моль
2. Обозначим нужный объем 6М раствора через х, тогда необходимый объем 2М раствора равен (0,5 — х).
3. Число молей НСl в х литрах 6М раствора n1(НСl) = 6х;
4. число молей НСl в (0,5 — х) литрах 2М раствора n2(НСl) = 2 (0,5 — х)
Таким образом, для приготовления требуемого раствора надо взять 125 мл 6М и 375 мл 2М растворов НСl.
Задача 10.
Чему равна молярность 36%-ного раствора НСl, плотность которого 1,18 г/мл?
Решение:
Пусть дан 1 л 36%-ного раствора НСl; рассчитаем его массу: m(р-р) = V(р-р) ∙ ρ(р-р) = 1000 мл ∙1,18 г/мл = 1180 г.
Рассчитаем массу и количество вещества НСl в этом растворе: m(НСl) = m(р-р) ∙ ω(НСl) = 1180 г ∙ 0,36 = 424,8 г.

Задача 11.

Проверьте себя.
1.Что такое растворы? 2. Как классифицируют растворы по агрегатному состоянию? 3. Из каких компонентов состоит жидкий раствор? 4. Какие процессы протекают при растворении веществ в жидких растворителях? 5. Что такое гидраты? 6. Что такое гидратация? 7. Что такое насыщенные растворы? 8. Что такое ненасыщенные растворы? 9. Что такое разбавленный раствор? 10. Что такое концентрированный раствор? 11. Что называется массовой долей растворенного вещества? 12. Что показывает коэффициент растворимости? 13. Что показывает процентная концентрация? 14. Что такое молярная концентрация?
Выполните самостоятельно.
1. В какой массе воды надо растворить KN03 массой 120 г, чтобы получить раствор, насыщенный при 30°С? 2. Определить массовую долю (%) кристаллизационной воды в медном купоросе, глауберовой соли, кристаллической соде. 3. Какая масса хлорида меди (II) СuСl2 содержится в растворе объемом 15л, если его молярная концентрация 0,3моль/л? 4. Из какой массы медного купороса можно получить сульфат меди (II) массой 80 г? 5.
Ответьте на вопросы своего варианта, ответы занесите в бланк для ответа:


- Как называются растворы, в которых растворителем является вода?
- Что является растворителем в неводных растворах?
- Верно ли, что растворение — это сложный физико-химический процесс?
- Верно ли утверждение, что физический процесс протекает с поглощением теплоты, а химический-с выделением?
- К какому процессу физическому или химическому относится разрушение структуры раство-ряемого вещества и распределение его частиц между молекулами растворителя?
- К какому процессу относится взаимодействие молекул растворителя с частицами растворенного вещества?
- Как называются продукты переменного состава, которые образуются при химическом взаимо-действии частиц растворенного вещества с молекулами растворителя?
- Какое название имеют сольваты, если растворителем является вода?
- Как называется процесс образования сольватов?
- Как называется процесс образования гидратов?
- Как называются кристаллические вещества, содержащие молекулы воды?
- Как называется вода, входящая в состав кристаллогидратов?
- Как называется раствор, который содержит максимальное количество растворяемого вещества при данной температуре?
- Как называется раствор, который содержит меньше растворяемого вещества при данной температуре?
- Какой показатель является количественной характеристикой растворимости?
- Как называется коэффициент показывающий, какая максимальная масса вещества может раствориться в 100 г растворителя при данной температуре?
- Верно ли утверждение, что растворимость в воде выражают в граммах вещества на 100 г воды?
- Верно ли утверждение, что растворы — гомогенные (однородные) системы переменного состава, которые содержат два или несколько компонентов?
- Верно ли утверждение, что наиболее распространены жидкие растворы?
- Верно ли утверждение, что жидкие растворы состоят из растворителя (жидкости) и растворенных веществ (газообразных, жидких, твёрдых)?
- Верно ли утверждение, что разбавленный раствор содержит мало растворителя?
- Верно ли утверждение, что концентрированный раствор — содержит много растворенного вещества?
- Верно ли утверждение, что массовой долей растворенного вещества называется отношение массы растворенного вещества к массе раствора.
- Какой буквой обозначается массовая доля растворенного вещества?
- В каких единицах выраженная массовая доля вещества?
- Как называется массовая доля растворенного вещества, выраженная в процентах?
- Какая концентрация показывает число молей растворенного вещества в одном литре раствора?
- Какой буквой обозначается молярная концентрация?
- Как обозначается сантимолярный раствор?
- Как обозначается пятимолярный раствор?
- Имеется 700г раствора с массовой долей кислоты 10%. Какой станет массовая доля вещества, если данный раствор разбавить 0,8 г воды?
- Какой станет массовая доля соли в растворе, если к 60 г раствора с массовой долей соли 20% добавить 40 мл воды?
- К 280 г 8%-ного раствора ацетата натрия добавили 120 мл воды. Массовая доля ацетата натрия в растворе равна…
- К 1 л аккумуляторной серной кислоты (ρ = 1,05 г/мл, массовая доля кислоты 0,3) добавили 196 г серной кислоты. Массовая доля кислоты в полученном растворе равна…
- Какой объем воды надо добавить к 2 кг 40%-ного сахарного сиропа для получения 10%-ного раствора?
- К 450 мл раствора 32%-ной азотной кислоты плотностью 1,2 г/мл прибавили 0,35 л воды. Массовая доля кислоты в полученном растворе равна …
- Масса соли, которую необходимо растворить в 50 г воды для приготовления 20%-ного раствора, равна …
- Какую массу КОН необходимо растворить в 150 г воды для получения раствора с массовой долей 25%?
- К 240 г 4%-ного раствора КСl добавили 10 г КСl. Массовая доля КСl в полученном растворе равна …
- При растворении в 270 г воды сульфата калия был получен раствор с массовой долей 10%. Масса растворенного К2SO4 равна…
- К раствору сульфида калия массой 60 г с массовой долей 4% добавили 1,6 г этой же соли. Массовая доля соли в полученном растворе равна …
- Масса уксусной кислоты, которая содержится в 0,25 л раствора СН3СООН с массовой долей 80% (плотность 1,1 г/мл), равна …
- Какой объем хлороводорода (н.у.) потребуется для получения 1 л раствора (ρ=1.15г/см3) с массовой долей хлороводорода 57%?
- Массовая доля кислоты в растворе, полученном при растворении 11,2 л (н.у.) йодоводорода в 1 л воды, равна…
- Масса нитрата натрия, которую необходимо растворить в 150 г раствора с массовой долей 10% для получения раствора с массовой долей 12%, равна …
- К 180 г 8%-ного раствора хлорида натрия добавили 20 г NaCl. Массовая доля хлорида натрия в образовавшемся растворе равна…
- Масса гидроксида натрия, который следует добавить к 200 мл 16%-ного раствора гидроксида натрия плотностью 1,17 г/мл, чтобы массовая доля вещества в растворе возросла до 20%, равна…
- При нагревании 400 г 25%-ного раствора аммиака 20 г этого вещества улетучилось. Массовая доля аммиака в растворе после нагревания равна…
- Какая масса азотной кислоты содержится в 1 л ее 20%-ного раствора плотностью 1,05 г/мл?
- Масса воды, которую необходимо добавить к 200 г раствора, приготовленного с использованием 10,6 г карбоната натрия, чтобы массовая доля карбоната натрия уменьшилась до 2%, равна…
- Количество серной кислоты, которое необходимо добавить к 300 г 8%-ного раствора для повышения массовой доли растворенного вещества до 12%, равно…
- Масса 92%-ного раствора этанола, необходимого для получения 1,12 л этилена (н.у.), равна…
- Какое количество вещества карбоната натрия требуется для приготовления 1,5 л раствора с массовой долей растворенного вещества 5% и плотностью 1,2 г/мл?
- 200 мл 36,5%-ного раствора соляной кислоты (плотность 1,18 г/мл) оставили открытым в вытяжном шкафу, в результате концентрация кислоты снизилась до 30%. Масса испарившегося хлороводорода равна …
- Какая масса воды содержится в растворе, полученном при добавлении в 200 г 8%-ного раствора хлорида кальция 4 г этой соли и 16 мл воды?
- К 400 мл уксусной эссенции (содержание кислоты 70%, плотность 1,3 г/мл) требуется добавить _________кг воды для того, чтобы получить пищевой уксус (5%-ный).
- Смешали 120 г раствора серной кислоты с массовой долей 20% и 40 г 50%-ного раствора того же вещества. Массовая доля кислоты в полученном растворе равна …
- Смешали 300 г раствора с массовой долей соли 20% и 500 г раствора с массовой долей 40%. Массовая доля соли в полученном растворе равна…
- Смешали 600 г 20%-ного и 200 г 50%-ного растворов азотной кислоты. Массовая доля кислоты в полученном растворе равна …
- К 200 г 10%-ного раствора соли прибавили 400 г 20%-ного раствора. Массовая доля соли в полученном растворе равна …
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.
По способности проводить электрический ток в водном растворе или в расплаве вещества делятся на электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К ним относятся соли, кислоты, основания. В этих веществах имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К ним относятся, например, кислород, водород, многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Процесс распада электролитов на ионы в водном растворе или расплаве называется электролитической диссоциацией, или ионизацией.
Шведский ученый С. Аррениус создал теорию электролитической диссоциации (ТЭД) в 1887 г. Основные положения теории: 1.Электролиты при растворении в воде или плавлении распадаются на ионы. 2. В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Поэтому положительные ионы называются катионами, отрицательные ионы— анионами. В растворе любого электролита общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (так как растворы электролитов электронейтральны). Ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т. е. являются гидратированными ионами.

При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие молекул с молекулами Н20. Под влиянием этого взаимодействия изменяется характер связи в молекуле растворяемого вещества: сначала связь становится более полярной, а затем переходит в ионную связь. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.

Главной причиной диссоциации в водных растворах является гидратация ионов. Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации).

Степень диссоциации зависит от: — природы растворителя, — природы растворяемого вещества, — концентрации раствора, — температуры и других факторов. При уменьшении концентрации электролита, т. е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами в растворе и уменьшается возможность соединения их в молекулы. При повышении температуры степень диссоциации, как правило, увеличивается. В зависимости от степени диссоциации электролиты делятся на сильные и слабые. Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электролитам относятся: 1) соли; 2) сильные кислоты (НСlO4, НСlO3, HNО3, H2SО4, HCl, HBr, HI и др.); 3) щелочи (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2).Процесс диссоциа-ции сильных электролитов необратим. Сильные электролиты в водных растворах находятся только в виде ионов. Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%). К слабым электролитам относятся: 1) слабые кислоты (НСlO2, НСlO, HNO2, H2SO3, H2CO3, H2SiO3, Н3РO4, Н3РO3, Н3ВO3, СН3СООН, H2S, HCN, HF и др.); 2) слабые нерастворимые в воде основания (Fe(OH)2, Pb(OH)2, Cu(OH)7 и др.); 3) гидроксид аммония (NH4OH); 4) вода (Н2O). Диссоциация слабых электролитов — процесс обратимый. Электролиты являются составной частью жидкостей и плотных тканей живых организмов. Ионы натрия Na+, калия К+, кальция Са2+, магния Mg2+, водорода Н+, анионы ОН—, Сl—, SO42-, НСО3— имеют большое значение для физиологических и биохимических процессов. Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н+, чем и объясняются общие свойства кислот. Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН—, чем и обусловлены общие свойства оснований. Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид-анионы ОН—, т. е. диссоциируют по типу кислоты и по типу основания, поэтому они могут реагировать и с кислотами, и с основаниями. Нормальные соли — сильные электролиты, o6pазующие при диссоциации катионы металла и анионы кислотного остатка. Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток. Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп ОН—. Вода — слабый амфотерный электролит. Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды (КН2О): Н2О= [Н+]∙[ОН—] КН2О — величина постоянная, и при температуре 25°С КН2О = 10 -7∙10-7= 10-14 Среду любого водного раствора можно охарактеризовать концентрацией ионов водорода Н+ или гидроксид-ионов ОН—. Нейтральная среда — это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов: [Н+]=[ОН—] = 10 -7моль/л. Кислая среда — это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов: [Н+] > [ОН—],[Н+] > 10-7 моль/л. Щелочная среда — это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов: [Н+] < [ОН—], [Н+] < 10-7 моль/л Для характеристики сред растворов удобно использовать так называемый водородный показатель рН (пэ-аш).
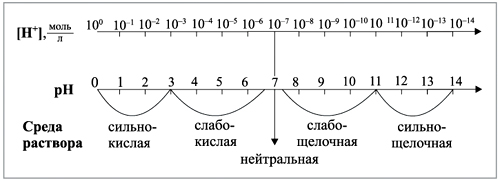
Водородным показателем рН называется отрицательный десятичный логарифм концентрации ионов водорода: рН = -lg[H+].

Индикаторами называются вещества, которые обратимо изменяют свой цвет в зависимости от среды растворов, т. е. рН раствора.

Определение рН растворов очень важно в медицине, науке, технике, сельском хозяйстве. Изменение рН крови или желудочного сока является диагностическим тестом в медицине. Отклонения рН от нормальных величин даже на 0,01 единицы свидетельствуют о патологических процессах в организме. Постоянство концентраций ионов водорода Н+ является одной из важных констант внутренней среды живых организмов. При нормальной кислотности желудочный сок имеет рН 1,7; рН крови человека равен 7,4; слюны — 6,9. Каждый фермент функционирует при определенном значении рН.
РЕАКЦИИ ОБМЕНА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ.
Реакции, протекающие между ионами, называются ионными реакциями. С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. B ионных уравнениях формулы веществ записывают в виде ионов или в виде молекул. В виде ионов записывают формулы: сильных кислот (НСlO4, H2SO4, HNO3, HI и др.); сильных оснований (щелочей — CsOH, NaOH, КОН, Са(ОН)2, Ва(ОН)2 и др.); растворимых в воде солей (NaBr, KNO3, ВаСl2, Al2(SO4)3). B виде молекул записывают формулы: воды Н2O; слабых кислот (HNO2,HCN,H3PO4,H2SO3, СН3СООН); слабых оснований (NH4OH, Cu(OH)2, Fe(OH)3); малорастворимых солей : AgCl, BaSO4, CaC03, FeS; амфотерных гидроксидов: Аl(ОН)3, Zn(OH)2, Сr(ОН)3; формулы газообразных веществ (СO2, SO2, H2, H2S, NH3 и др.); формулы оксидов металлов и неметаллов (Na2O, CaO, P2O5, SiO2, B2O3). Большая часть молекул слабых электролитов в растворе не диссоциирует на ионы. Реакции между сильными электролитами, в результате которых образуются: а) малорастворимые вещества; б) малодиссоциирующие вещества — слабые электролиты; в) газообразные или летучие вещества являются необратимыми. Рассмотрим реакцию обмена, в которую вступают сильные электролиты сульфат натрия и хлорид бария: 1. Составим молекулярное уравнение реакции между этими электролитами: Na2SO4 + BaCl2= BaSO4 + 2NaCl 2. Реагенты: и сульфат натрия и хлорид бария это сильные электролиты, поэтому в растворе они будут находиться в виде ионов: сульфат натрия: Na2SO4 → 2Na+ + SO42- и хлорид бария: BaCl2 → Ba2++2Cl— 3. Продукты реакции: сульфат бария — нерастворимая соль (таблица растворимости), выпадает в осадок. Следовательно, ионы Ba2+ и SO42- уходят из раствора. Другая соль — хлорид натрия — растворимая и является сильным электролитом, поэтому она будет находиться в растворе в ионном виде: NaCl → Na+ + Cl— 4. Составляем полное ионное уравнение реакции, учитывая коэффициенты: 2Na++ SO42- + Ba2++2Cl— = BaSO4↓+ 2Na+ + 2Cl— 5. В левой и правой частях уравнения имеются ионы Na+ и Cl— , они не принимают участия в реакции, поэтому их можно исключить из уравнения (сократить). 6. Составляем сокращённое ионное уравнение реакции: SO42- + Ba2+ = BaSO4↓ именно оно выражает сущность данной реакции.
Если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т.е. до конца не протекают: Cu(OH)2↓+2HCl↔CuCl2 + 2H2O. Сокращённое ионное уравнение такой реакции будет выглядеть так: Cu(OH)2↓+2H+↔Cu2+ + 2H2O
Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают: 2NaCl + Ca(NO3)2 ≠ 2NaNO3 + CaCl2 При смешивании их растворов образуется смесь ионов, которые не соединяются друг с другом: 2Na+ + 2Cl— + Ca2+ + 2NO3— ≠ 2Na+ + 2Cl— + Ca2+ + 2NO3— Все ионы в левой и правой частях уравнения можно сократить. Делаем вывод, что между растворами NaCl + Ca(NO3)2 никакого взаимодействия не происходит.
ВЫПОЛНИТЕ ДОМАШНЮЮ САМОСТОЯТЕЛЬНУЮ РАБОТУ. Найдите задания своего варианта и заполните бланк для ответа.

1. Почему водный раствор серной кислоты проводит электрический ток, а безводная серная кислота не проводит? Ответ объясните. 2. В чем сходство и различие следующих частиц: а) К0 и К+, б) Вr0 и Вr —, в) S0 и S2-? Как называются эти частицы? 3. Какие из следующих ионов являются катионами и какие анионами: Al3+, Sr2+, N03—, Mn2+, Pb2+, SO2-, P043-, Rb+? 4. Раствор фосфорной кислоты разбавили в 3 раза. Уменьшится или увеличится степень диссоциации кислоты? 5. Изобразите схему образования гидратированных ионов в водном растворе бромоводорода. 6. Составьте уравнения электролитической диссоциации следующих электролитов: Ва(ОН)2, Аl(ОН)3, СаСl2, НВr. 7. Даны электролиты: Mn(OH)2, НМn04, СН3СООН, Fe(HS04)3, FeOHCl. Какие из них образуют ионы водорода? Докажите это уравнениями диссоциации. 8. Составьте формулы электролитов, состоящих из катионов Na+, Cu2+, Ba2+, Fe2+ и анионов: S2-, SO42-,ОН—,HS—, NO2—, Назовите эти электролиты. 9. Даны электролиты: Mn(OH)2, НМп04, СН3СООН, Fe(HS04)3, FeOHCl. Какие из них образуют гидроксид-ионы? Докажите это уравнениями диссоциации. 10. Напишите полные и сокращенные ионные уравнения следующих реакций: a) Ca(NO3)2 + К2СO3 → CaCO3 + KNO3; б) HNO3 + Ва(ОН)2 → Ba(NO)2 + Н2O; в) Ba(NO2)2 + K2SO4 → BaSO4 + KNO2 г) K2CO3 + НСl→ КСl + H2O+ CO2; д) Na2CO3 + H2SO4 →Na2SO4 + H2O + CO2; е) FeCl2 + AgNO3 → Fe(NO3)2 + AgCl. 11.Составьте молекулярные и ионные уравнения реакций между растворами веществ: а) КОН и MgCl2, б) NaOH и H2SO, в) K2S и НСl, г) CuCl2 и NaOH, д) H2SО4 и BaCl2, е) MgSO4 и BaCl2. 12. Какие из этих реакций обратимы? Какие необратимы? Почему? а) Fe(OH)2 + HNO3 → Fe(NO3)2 + H2O; б) Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O; в) MgCO3 + HCl → MgCl2 + H2O + CO2; г) Cu(OH)2 + HNO3 → Cu(NO3)2 + H2O; д) Al(OH)3 + H2SO4 → Al2(SO4)3 + H2O; е) AlCl3 + AgNO3 → Al(NO3)3 + AgCl;

ГИДРОЛИЗ СОЛЕЙ.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение). Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты. Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид ионами ОН— или ионами водорода Н+ из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо: Н20 → Н+ + ОН—. Поэтому в водном растворе соли появляется избыток свободных ионов Н+ или ОН—, и раствор соли показывает кислую или щелочную среду. Гидролиз — процесс обратимый для большинства солей. Количественно гидролиз характеризуется степенью гидролиза (h). Степень гидролиза равна отношению числа гидролизованных молекул соли к общему числу растворенных молекул:

где п — число молекул соли, подвергшихся гидролизу; N — общее число растворенных молекул соли. Степень гидролиза зависит от природы соли, концентрации раствора, температуры. При разбавлении раствора, а также при повышении температуры степень гидролиза увеличивается. Любую соль можно представить как продукт взаимодействия кислоты с основанием.

1). Гидролиз не возможен
Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. рН таких растворов = 7. Реакция среды остается нейтральной.
2). Гидролиз по катиону (в реакцию с водой вступает только катион)

В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3,MgSO4) гидролизу подвергается катион: FeCl2 + HOH <=>Fe(OH)Cl + HCl
Fe2+ + 2Cl— + H+ + OH— <=> FeOH+ + 2Cl— + Н+
В результате гидролиза образуется слабый электролит, ион H+ и другие ионы. рН раствора < 7 (раствор приобретает кислую реакцию).
3). Гидролиз по аниону (в реакцию с водой вступает только анион)
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3,CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН—и другие ионы.
K2SiO3 + НОH <=>KHSiO3 + KОН
2K+ +SiO32- + Н+ +ОH—<=> НSiO3— + 2K+ + ОН—
рН таких растворов > 7 (раствор приобретает щелочную реакцию).

4). Гидролиз по катиону и аниону (в реакцию с водой вступает и катион и анион)
Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3,Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива. Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной: Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑ Гидролиз — процесс обратимый. Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота.

Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Гидролиз — это реакция обменного разложения веществ водой.
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание.

Гидролиз этой соли протекает по аниону, потому что она образована слабой кислотой Н2СО3 и сильным основанием КОН. Так как Н2СО3 — двухосновная кислота, гидролиз К2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза К2СО3 являются кислая соль КНСО3 и гидроксид калия КОН.

Это гидролиз кислой соли, которая образовалась в результате первой ступени:

Продуктами второй ступени гидролиза К2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени. Среда раствора соли К2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН—.
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Гидролиз протекает по катиону, так как соль образована слабым основанием Ni(ОН)2 и сильной кислотой НСl.

Продуктами первой ступени гидролиза NiСl2 являются основная соль NiОНСl и сильная кислота НСl.

Это гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):

Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НСl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiСl2 — кислая, рН < 7, потому что в растворе увеличивается концентрация ионов Н+.
ВЫПОЛНИТЕ САМОСТОЯТЕЛЬНУЮ РАБОТУ СОГЛАСНО ВАШЕГО ВАРИАНТА.

1. Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

2. Установите соответствие между названием соли и характером среды её водного раствора: к каж-дой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

3. Установите соответствие между названием соли и характером среды её водного раствора.

4.Установите соответствие между названием соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

5.Установите соответствие между названием соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

6.Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.

7. Кремниевая кислота слабее угольной. Запишите уравнения гидролиза карбоната и силиката натрия и значения рН среды.
8. Составьте молекулярные и ионные уравнения гидролиза солей Pb(NO3)2, NaNO3. Какое значение рН (рН ≤7, рН ≥ 7) имеют растворы этих солей?
9. Составьте молекулярные и ионные уравнения гидролиза солей K2SO3, KCl. Какое значение рН (рН ≤7, рН ≥ 7) имеют растворы этих солей?
10. Составьте молекулярные и ионные уравнения гидролиза солей Cr2(SO4)3 и Na2SiO3. Какое значение рН (рН ≤ 7, рН ≥ 7) имеют растворы этих солей?.
11. Составьте молекулярные и ионные уравнения гидролиза солей Li3PO4, CuCl2. Какое значение рН (рН ≥7, рН ≤ 7) имеют растворы этих солей?
12. Составьте молекулярные и ионные уравнения гидролиза солей K3PO4, NH4Cl. Какое значение рН (рН ≥7, рН ≤ 7) имеют растворы этих солей?
ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ.
Чистые вещества в природе встречаются очень редко. В природе чаще всего встречаются смеси различных веществ. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы. Такие системы мы будем называть дисперсными.
Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме другого.
То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой.
Между дисперсионной средой и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы назы-ваются гетерогенными (неоднородными). И дисперсную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях – твердом, жидком и газообразном. В зависимости от сочетания агрегатного состояния дисперсной среды и дисперсной фазы можно выделить 9 видов таких систем.

По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся на:
- грубодисперсные (взвеси) с размерами частиц более 100 нм;
- тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм;
- гомогенные системы, или растворы с размером частиц менее 1 нм. Такая система однородна, поверхности раздела между частицами и средой нет.
Человек живет и работает в окружении дисперсных систем. Воздух, особенно воздух рабочих помещений, — это дисперсная система. Многие пищевые продукты, полупродукты и продукты их переработки представляют дисперсные системы (молоко, мясо, хлеб, масло, маргарин). Многие лекарственные вещества производятся в форме тонких суспензий или эмульсий, мазей, паст или кремов (протаргол, колларгол, жела-тиноль и др.). Дисперсными являются все живые системы. Мышечные и нервные клетки, волокна, гены, вирусы, протоплазма, кровь, лимфа, спинномозговая жидкость — все это, высокодисперсные образования. Протекающие в них процессы управляются физико-химическими закономерностями, которые изучает физикохимия дисперсных систем.
Дисперсными называют системы, в которых вещество находится в состоянии более или менее высокой раздробленности и равно-мерно распределено в окружающей среде. Науку о высокодисперсных системах называют коллоидной химией. В основе живого вещества лежат соединения, находящиеся в коллоидном состоянии. По своей физико-химической природе все жидкие лекарственные формы являются свободными всесторонне дисперсными системами, в которых лекарственные вещества (дисперсная фаза) равно-мерно распределены в жидкой дисперсионной среде. В зависимости от степени измельчения дисперсной фазы и характера связи ее с дисперсионной средой (растворителем) различают такие физико-химические системы как: — истинные растворы низко- и высокомолекулярных соединений; — коллоидные растворы (золи); — суспензии и эмульсии.
По агрегатному состоянию дисперсной фаз и дисперсионной среды системы классифицируют на:
1. Аэрозоли – дисперсная система, состоящая из твердых или жидких частиц, распределенных в газовой среде (обычно в воздухе). Аэрозоли, дисперсная фаза которых состоит из капелек жидкости, называются туманами, а в случае твердой фазы – дымами или пылью. Аэрозоли образуются при механическом измельчении и распылении твердых тел и жидкостей, взрывах, горении, распылении в пульверизаторах. Примеры различных типов дисперсных систем: Дисперсная фаза / дисперсионная среда Ж/Г (фаза)/(среда) – туман, облака Т/Г – пыль, дым;
2. Лиозоли:
а) эмульсии (средой и фазой являются не смешивающие между собой жидкости, например, масло и вода). Масло/Вода (фаза/среда) (эмульсии 1 рода или прямые эмульсии) – водно-жировая мантия нормальной и сухой кожи человека, косметическое молочко, современные косметические кремы, в том числе лечебной косметики, продукты питания — молоко, нежирная сметана и др.); Вода/Масло (эмульсии ІІ рода или обратные эмульсии) – водно-жировая мантия жирной кожи человека, сливки, сливочное масло, сырая нефть и др. 10
б) Коллоидные растворы, суспензии (Т/Ж) (дисперсной средой является жидкость, фазой – твердое вещество мало или нерастворимое в этой жидкости). Коллоидные растворы – дисперсные системы, в которых частицы вещества фазы обладают ультрамикроскопической (коллоидной) степенью измельчения (1 – 100 нм). Суспензии имеют большие размеры частиц по сравнению с коллоидами. Например, суспензиями являются цементные растворы, эмалевые краски, суспензии бентонитовой глины в воде. В природных условиях образо-вание суспензий происходит при диспергировании почв, грунтов, скальных пород под воздействием сил прибоя, приливноотливных явлений, при движении ледников и т.д.
3. Солиозоли — системы с твердой дисперсионной средой: Т/Т – твердые золи, минералы; Ж/Т – капиллярные системы почвы; Г/Т – пено-пласты.
В зависимости от величины межфазного взаимодействия дисперсные системы делятся на гидрофильные (вещество и растворитель – гидрофильные вещества (СаСО3 и Н2О). В гидрофильных системах межмолекулярное взаимодействие достаточно велико, поверх-ностное натяжение мало, и такие системы термодинамически достаточно устойчивы. Гидрофобные (сера (гидрофобное вещество), и вода (гидрофильный растворитель)). В гидрофобных системах межмолекулярное взаимодействие мало, т.к. частицы образуют вокруг себя только тонкую оболочку из молекул растворителя, поверхностное натяжение большое, вследствие чего система термодинами-чески нестабильна. Для существования устойчивых коллоидных растворов с гидрофобными веществами в них вводят стабилизаторы, в частности, ВМС (ПАВ) (растворимый кофе). Такие жидкости организма человека, как кровь, лимфа, спинно-мозговая жидкость, и другие представляют коллоидные системы, в которых ряд веществ, например, белки, холестерин, гликоген и др. находятся в коллоид-ном состоянии. Коллоидное состояние различных тканей живых организмов обуславливает разнообразие их свойств (состояние гелей, эластичность, набухание и др.). Кроме того, коллоидные вещества способны связывать большие количества воды (соединительная ткань), а также адсорбировать самые разнообразные вещества, что имеет важное значение при обмене веществ, процессах пищеварения, и воздействии лекарственных средств на организм.
ВЫПОЛНИТЕ САМОСТОЯТЕЛЬНУЮ РАБОТУ .
1.Назовите основные компоненты дисперсной системы: 1………. 2……….
2.Биологическим гелем является: 1. Хрящ 2. Воздух 3. Облака 4. Речная вода
3.Распределите дисперсные системы на отдельные группы в зависимости от агрегатного состояния дисперсной фазы и дисперсионной среды: жидкие среды организма, песчаные бури, воздух, попутный газ с капельками нефти, крем, пены, цветные стекла, текстильные ткани, шипучие напитки, медицинские и косметические средства, пористый шоколад, молоко, кирпич и керамика, природный газ, влажная почва, горные породы, строительные растворы, пасты, смог, порошки, нефть, пыль в воздухе, гели, дымы, сплавы, туман, золи.
Заполните таблицу «Дисперсные системы»:

4. Сходство суспензий и эмульсий заключается в том, что: 1. это гетерогенные системы 2. частицы видны не вооруженным глазом 3. они легко осаждаются 4. все ответы верны
5.Эмульсией является: 1. молоко 2. пена 3. желе 4. туман
6.К грубодисперсным системам относится: 1. раствор 2. золь 3. суспензия 4. гель
7. Дисперсной фазой керамических изделий является: 1. твердое вещество 2. Газ 3. Жидкость 4. зависит от вида керамического изделия
8. К эмульсиям относится: 1. крем 2. речной ил 3. цветное стекло 4. текстильные ткани
9. Дисперсная фаза шипучих напитков: 1. азот 2. Вода 3. углекислый газ 4. кислород
10. Аэрозолем является: 1. пудра 2. пылевое облако 3. лак для волос 4. все ответы верны
11.Хроматография – это: 1. способ разделения неоднородных смесей 2. вид дисперсной системы
3. дисперсионная среда 3. способ разделения однородных смесей
12.Допишите недостающие элементы таблицы «Дисперсные системы» (вопр.3):
13. Эмульсия — это система, образованная: 1. твердым веществом и газом 2. двумя различными жидкостями 3. жидкостью и газом 4. жидкостью и твердым веществом
15.Установите соответствие между примерами дисперсных систем и их названием:

Для закрепления изученного материала перейдите по ссылке: https://learningapps.org/watch?v=p2dxctrrn22 и выполните задания.
Выполните итоговый тест по темам «Периодическая система. Химическая связь.», перейдя по ссылке:https://onlinetestpad.com/s3qbthlnywbyi


0 Комментариев